Mga bagong publikasyon
Ang LM11A-31 na gamot ay nagpapabagal sa pag-unlad ng Alzheimer's disease sa pagsubok
Huling nasuri: 02.07.2025

Ang lahat ng nilalaman ng iLive ay medikal na nasuri o naka-check ang katotohanan upang masiguro ang mas tumpak na katumpakan hangga't maaari.
Mayroon kaming mahigpit na mga panuntunan sa pag-uukulan at nag-uugnay lamang sa mga kagalang-galang na mga site ng media, mga institusyong pang-akademikong pananaliksik at, hangga't maaari, ang mga pag-aaral ng medikal na pag-aaral. Tandaan na ang mga numero sa panaklong ([1], [2], atbp) ay maaaring i-click na mga link sa mga pag-aaral na ito.
Kung sa tingin mo na ang alinman sa aming nilalaman ay hindi tumpak, hindi napapanahon, o kung hindi pinag-uusapan, mangyaring piliin ito at pindutin ang Ctrl + Enter.

Sa isang kamakailang pag-aaral na inilathala sa journal Nature Medicine, ang mga siyentipiko ay nagsagawa ng randomized, double-blind, placebo-controlled phase 2a na pag-aaral upang suriin ang kaligtasan at bisa ng LM11A-31 sa paggamot ng Alzheimer's disease (AD) sa pamamagitan ng modulasyon ng p75 neurotrophin receptor (p75NTR).
Ang late-onset na AD ay ang pinakakaraniwang anyo ng dementia, na nailalarawan sa pamamagitan ng synaptic failure, pagkabulok, at pagkawala ng mga nerve cell. Bagaman ang dalawang nangungunang gamot para sa paggamot ng AD ay nagta-target sa akumulasyon ng abnormal na amyloid-β o tau na protina, tinutugunan lamang nila ang bahagi ng pathophysiology. Ang isa pang diskarte ay kinabibilangan ng pag-target sa mga receptor at signaling network na nakakaimpluwensya sa mga pangunahing biological pathway. Ipinapakita ng mga preclinical na pag-aaral na ang modulasyon ng p75NTR na may isang nobelang maliit na molekula ng kemikal, LM11A-31, ay binabawasan ang pagkawala ng synaptic na dulot ng amyloid at abnormal na tau.
Paglalarawan ng pag-aaral
Sa randomized na klinikal na pagsubok na ito, sinuri ng mga mananaliksik kung ang LM11A-31 ay maaaring makapagpabagal sa pag-unlad ng Alzheimer's disease sa pamamagitan ng modulating p75NTR sa mga tao.
Ang mga kalahok sa pag-aaral ay binigyan ng LM11A-31 na oral capsule sa mga dosis na 200 mg at 400 mg o placebo sa ratio na 1:1:1 sa 242 na pasyente na may banayad hanggang katamtamang hika sa loob ng 26 na linggo. Biologically nakumpirma ng mga kalahok ang Alzheimer's disease (cerebrospinal fluid amyloid β protein 42 (Aβ42) na antas sa ibaba 550 ng/L o Aβ42:β40 ratio sa ibaba 0.89) na na-diagnose ayon sa McKhann criteria, na may Mini-Psychiatric Examination (MMSE) na mga marka na 18 hanggang 26, Score na Depression sa DS0. binagong mga marka ng Hachinski Ischemic Scale (HIS) ≤ 4.0, pormal na edukasyon ≥ 8 taon, at nakaraang pagbaba ng cognitive ≥ 6 na buwan.
Ang mga karapat-dapat na kalahok ay kumuha ng acetylcholinesterase inhibitors (AChEIs) o bahagyang NMDA receptor antagonist sa loob ng ≥ 3 buwan bago ang pagpasok sa pag-aaral. Hindi sila umiinom ng mga ipinagbabawal na gamot gaya ng antipsychotics, benzodiazepines, antiepileptic na gamot, sedative, centrally active antihypertensives, nootropics (maliban sa ginkgo biloba), o opioid-containing analgesics.
Ang pangunahing kinalabasan ng pag-aaral ay kaligtasan at pagpapaubaya, na tinasa gamit ang Columbia Suicidal Thoughts and Behavior Severity Rating Scale (C-SSRS), mga mahahalagang palatandaan, presyon ng dugo, at mga hematological na parameter. Ginamit ang Structural magnetic resonance imaging (cMRI), fluorodeoxyglucose positron emission tomography (FDG-PET), at cerebrospinal fluid (CSF) biomarker upang masuri ang pangalawang cognitive na kinalabasan. Kasama sa mga panukala ng AD ang Thr181-phosphorylated tau, kabuuang tau protein, Aβ40, Aβ42, at aktibidad ng AChE. Gumamit ang team ng customized na neuropsychological test para masuri ang pangalawang cognitive outcome sa baseline, linggo 12, at 26.
Mga resulta ng pananaliksik
Natuklasan ng pag-aaral na ang LM11A-31 ay ligtas at mahusay na disimulado, na walang makabuluhang alalahanin sa kaligtasan. Ang pinakakaraniwang masamang pangyayari ay kinabibilangan ng pananakit ng ulo, pagtatae, eosinophilia, at nasopharyngitis, na may mga problema sa gastrointestinal at eosinophilia ang pangunahing dahilan ng paghinto. Mayroong higit pang mga paghinto sa 400 mg na grupo kumpara sa 200 mg at mga pangkat ng placebo. Ang MRI ay nagsiwalat ng walang mga alalahanin sa kaligtasan, kabilang ang mga abnormal na nauugnay sa amyloid. Walang makabuluhang pagkakaiba sa mga cognitive score o amyloid abnormalities sa pagitan ng dalawang grupo ng paggamot.
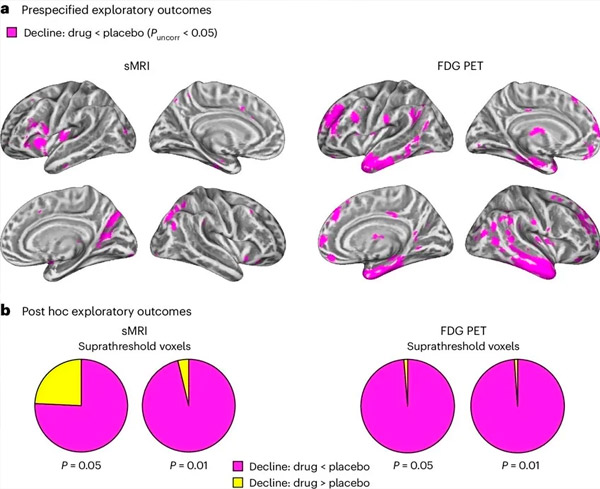
A. Sinusuri ng two-way mixed models analysis ng covariance ang mga interaksyon sa pagitan ng paggamot (droga o placebo) at oras (pre-o post-treatment). Ang isang one-tailed t-contrast na sumusuri sa interaksyon ng hypothesis (ang gamot ay nagpapabagal sa pag-unlad kumpara sa placebo) ay nagpakita na ang LM11A-31 na paggamot ay nagpabagal ng longitudinal degeneration (kaliwang mga panel) at glucose hypometabolism (kanang mga panel) sa grupo ng gamot (cMRI, n = 127; PET, n = 121) = n = M6, PET, n = 121) (kumpara sa pangkat ng placebo, n = 6). Ang mga voxel na nagpapakita ng pakikipag-ugnayang ito ay ipinapakita sa isang hindi naayos na threshold ng P <0.05 (magenta) sa isang cortical surface na tukoy sa populasyon. Ang kaliwa at kanang hemisphere ay ipinapakita sa itaas at ibabang mga hilera, ayon sa pagkakabanggit. Ang mga rehiyon ng utak na nagpapakita ng mga pakikipag-ugnayan na hindi naaayon sa hypothesis ay ipinapakita sa Figure 7 sa Karagdagang Data.
B. Kabuuang bilang ng mga voxel sa paunang-natukoy na vulnerable na mga rehiyon ng utak ng AD (kabuuang lugar ng mga pie chart) na nagpapakita ng alinman sa isang pakikipag-ugnayan alinsunod sa hypothesis (magenta) o isang pakikipag-ugnayan na hindi naaayon sa hypothesis (dilaw) sa bawat modality ng imaging (cMRI, kaliwang panel; FDG PET, kanang panel) sa lalong liberal na mga threshold ng P.0.0 <5 at P <0.00. Ipinakita ng mga simulation ng Monte Carlo na ang mga ratio ng mga voxel na nagpapakita ng mga epekto alinsunod sa hypothesis kumpara sa hindi naaayon sa hypothesis ay makabuluhang mas mataas kaysa sa mga naobserbahan batay sa random na nabuong data para sa parehong cMRI at PET (P <0.001 para sa bawat modality; two-tailed test).
Epektibong binawasan ng LM11A-31 ang pagtaas ng CSF Aβ42 at Aβ40 kumpara sa pangkat ng placebo. Nagpakita din ang gamot ng pagbawas sa median na taunang pagbabago ng porsyento sa presynaptic protein biomarker SNAP25 at isang pagbawas sa postsynaptic biomarker NG, na nagpapahiwatig ng pagbagal ng pagkawala ng presynaptic at postsynaptic na mga koneksyon. Binawasan din ng LM11A-31 ang pagtaas sa YKL40, na humahantong sa pagbaba sa mga marka ng MMSE at pagtaas ng mga marka ng ADAS-Cog-13. Binawasan din ng gamot ang pagkawala ng gray matter sa frontal lobe at posterior parietal cortex at pagbaba ng glucose metabolism sa mga lugar tulad ng entorhinal cortex, temporal cortex, hippocampus, insular cortex, at prefrontal cortex.
Konklusyon
Napagpasyahan ng pag-aaral na ang modulasyon ng p75NTR ng LM11A-31 ay angkop para sa mas malalaking klinikal na pagsubok. Natugunan ng LM11A-31 ang pangunahing endpoint ng kaligtasan at mahusay na pinahintulutan sa mga pasyente na may banayad hanggang malubhang AD. Ang mga resulta ay nagpapahiwatig ng pangangailangan para sa karagdagang pag-aaral na may mas mahabang tagal ng paggamot upang masuri ang potensyal ng maliliit na molekula upang makontrol ang p75NTR bilang isang therapy na nagbabago ng sakit sa AD. Ipinakita ng pag-aaral na ang LM11A-31 ay makabuluhang naapektuhan ang ilang mga biomarker, kabilang ang Aβ40, Aβ42, SNAP25, NG, at YKL40, na nagpapahiwatig ng pagbagal ng pag-unlad ng pathological. Maaaring suriin ng mga pag-aaral sa hinaharap ang mga karagdagang tagapagpahiwatig ng kalusugan ng glial.
