Mga bagong publikasyon
Binibigyang-diin ng pag-aaral ang pangangailangan para sa mga therapy na partikular sa uri ng cell para sa HIV
Huling nasuri: 02.07.2025

Ang lahat ng nilalaman ng iLive ay medikal na nasuri o naka-check ang katotohanan upang masiguro ang mas tumpak na katumpakan hangga't maaari.
Mayroon kaming mahigpit na mga panuntunan sa pag-uukulan at nag-uugnay lamang sa mga kagalang-galang na mga site ng media, mga institusyong pang-akademikong pananaliksik at, hangga't maaari, ang mga pag-aaral ng medikal na pag-aaral. Tandaan na ang mga numero sa panaklong ([1], [2], atbp) ay maaaring i-click na mga link sa mga pag-aaral na ito.
Kung sa tingin mo na ang alinman sa aming nilalaman ay hindi tumpak, hindi napapanahon, o kung hindi pinag-uusapan, mangyaring piliin ito at pindutin ang Ctrl + Enter.
Ipinakita ng mga mananaliksik sa Unibersidad ng Illinois ang kahalagahan ng pag-target sa mga partikular na uri ng cell sa paggamot sa HIV. Ang kanilang pag-aaral, na inilathala sa journal Proceedings of the National Academy of Sciences, ay isa sa mga unang tumingin sa differential o cell type-specific na epekto ng HIV latency modulation sa myeloid cells, isang uri ng immune cell na ginawa sa bone marrow.
Ang isa sa mga pangunahing hadlang sa pag-aalis ng impeksyon sa HIV ay ang pamamahala sa latency, o ang panahon kung saan natutulog ang isang nahawaang cell at hindi makagawa ng virus. Ang mga nakatagong selula ng HIV ay kinokolekta sa katawan sa mga lugar na kilala bilang mga reservoir. Ang mga nakatagong reservoir ay may problema dahil maaari silang magsimulang gumawa ng virus anumang oras.
Ang kumpletong pagpuksa ng sakit ay mangangailangan ng pag-alis ng lahat ng mga nakatagong selula mula sa katawan o permanenteng paglaban sa activation stimuli. Gayunpaman, ang muling pag-activate ay maaaring ma-trigger ng iba't ibang mga kadahilanan, kabilang ang mga senyas na nagdidirekta sa pagkakaiba-iba ng myeloid cell.
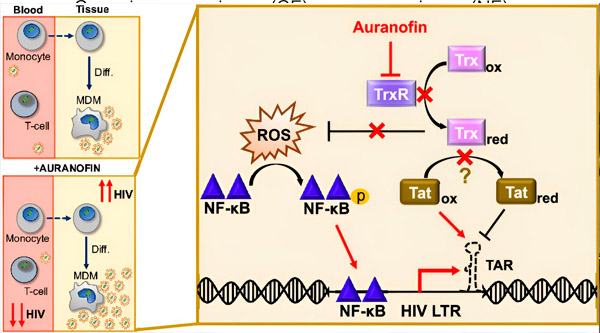
Ang regulasyon ng HIV latency sa monocyte-derived macrophage (MDMs) ay maaaring magdulot ng panganib sa viral dissemination. Ang pagkakaiba-iba ng mga monocytes sa macrophage ay maaaring mag-trigger ng HIV reactivation, na posibleng magsulong ng viral dissemination sa mga tissue (kaliwa sa itaas). Ang isang klinikal na kandidato, si Auranofin, ay nagbabawas ng viral DNA sa dugo at nagtataguyod ng HIV latency sa mga T cells at monocytes, ngunit nagiging sanhi ng HIV reactivation sa MDMs (ibaba sa kaliwa). Sa mga MDM, hinuhusgahan namin na ang pagsugpo sa TrxR ni Auranofin ay humahantong sa akumulasyon ng mga reactive oxygen species (ROS), na nag-uudyok sa NF-κB activation at activation ng HIV LTR promoter (kanan). Ang pagsugpo sa TrxR ay potensyal na binabawasan ang pagbabawas ng substrate, na nagpapahintulot sa protina ng Tat na manatiling mas pinipiling na-oxidized, kung saan maaari itong magbigkis sa TAR at simulan ang transkripsyon ng HIV. Pinagmulan: Proceedings of the National Academy of Sciences (2024). DOI: 10.1073/pnas.2313823121
Sa loob ng maraming taon, ang pananaliksik sa paggamot sa HIV ay nakasentro sa dalawang paraan na kilala bilang "shock and kill" at "block and lock." Gumagana ang dating kasabay ng antiretroviral therapy upang i-activate ang mga nahuling nahawaang selula at patayin ang mga ito sa pamamagitan ng apoptosis, o naka-program na pagkamatay ng cell, habang pinipilit ng huli ang mga nahawaang selula sa isang malalim na estadong nakatago kung saan hindi na sila makapag-reactivate nang mag-isa.
Ang pananaliksik tungkol sa mga pamamaraan na ito ay tradisyonal na nakatuon sa isang uri ng white blood cell na tinatawag na T cells, na siyang pangunahing target ng HIV infection. Gayunpaman, ang mga nakatagong reservoir ay binubuo ng higit pa sa mga selulang T; sa katunayan, naglalaman ang mga ito ng dose-dosenang iba't ibang uri ng cell, bawat isa ay may sariling natatanging pattern ng pagpapahayag ng gene ng HIV.
"May isang malaking pagkakaiba-iba ng mga cell, kahit na sa loob ng isang linya," sabi ni Collin Kieffer, isang assistant professor ng microbiology at isang may-akda ng papel. "Ang pagkakaiba-iba ng tugon sa mga reservoir na ito ay tumataas sa bawat bagong uri ng cell."
Si Alexandra Blanco, isang nagtapos na estudyante sa Kieffer's lab, ay gustong pag-aralan ang mga uri ng cell na napalampas sa tradisyonal na pananaliksik sa HIV. Nakatuon sa mga myeloid cell, lumikha siya ng isang clone library na naglalaman ng 70 populasyon ng mga monocyte na may latently infected. Pagkatapos ay sinuri ni Blanco ang mga clonal na populasyon at ang kanilang mga tugon sa pag-activate. Ang mga tugon ay malawak na iba-iba, na nagbibigay-diin sa malaking pagkakaiba-iba sa loob ng isang uri ng cell.
Ang obserbasyon na ito ay nagtaas ng bagong tanong: ang iba't ibang uri ng cell ba ay may iba't ibang tugon sa mga paggamot sa latency ng HIV? Sa katunayan, ang kanilang mga natuklasan ay nagpakita na ang ilang mga HIV latency therapies ay maaaring magsulong ng latency sa T cells at monocytes, habang maaari nilang baligtarin ang latency sa macrophage.
"Hindi lahat ng mga selula sa katawan ay pareho," sabi ni Kieffer. "Kaya makatuwiran na hindi lahat ng mga nahawaang selula ay tutugon sa virus sa parehong paraan."
Itinatampok ng kanilang papel ang pangangailangan para sa hinaharap na paggamot sa HIV upang isaalang-alang ang lahat ng uri ng cell at kung paano maaaring tumugon ang bawat cell sa mga potensyal na therapy.
Ang kanilang mga natuklasan ay binuo sa pananaliksik ni Roy Dar, isang dating propesor ng bioengineering sa Illinois na ang lab ay nag-aral ng heterogeneity sa pagpapahayag ng gene ng HIV.
"Siya ang nagsimula, at kinuha namin ito at itinayo kung nasaan ito ngayon," sabi ni Kieffer. "Kaya ang pakikipagtulungan ay talagang nagsimula sa mga resultang ito. Ito ay naging isang bagong direksyon para sa aming lab, at kami ay talagang nasasabik tungkol dito."
Ang isang karagdagang at hindi inaasahang paghahanap mula sa pagsusuri ni Blanco ay nagsiwalat ng mga pagbabago sa laki at hugis ng cell bilang tugon sa impeksyon, na nagmumungkahi na maaaring baguhin ng HIV ang cell morphology. Ang susunod na layunin ni Blanco ay tukuyin ang mga biyolohikal na mekanismong pinagbabatayan ng mga pagbabagong ito sa phenotypic.
Inaasahan din ni Kieffer at ng kanyang mga miyembro ng lab na i-reproduce ang kanilang mga resulta, na kadalasang ginagawa sa isang cell line, sa mga pangunahing cell. Ang muling paggawa ng mga resulta sa isang mas katulad na modelo ng tao ay mapapabuti ang klinikal na kaugnayan ng pag-aaral, ipinaliwanag ni Kieffer.
"Gusto naming gumawa ng mas malalaking screen sa mga T cell, monocytes at macrophage upang matukoy ang mga potensyal na gamot na maaaring gumana sa lahat ng mga uri ng cell na ito," sabi ni Blanco. "Maaari tayong makahanap ng higit pang mga molekula na hindi kumikilos sa isang paraan na partikular sa uri ng cell."
