Medikal na dalubhasa ng artikulo
Mga bagong publikasyon
Human immunodeficiency virus (HIV)
Huling nasuri: 04.07.2025

Ang lahat ng nilalaman ng iLive ay medikal na nasuri o naka-check ang katotohanan upang masiguro ang mas tumpak na katumpakan hangga't maaari.
Mayroon kaming mahigpit na mga panuntunan sa pag-uukulan at nag-uugnay lamang sa mga kagalang-galang na mga site ng media, mga institusyong pang-akademikong pananaliksik at, hangga't maaari, ang mga pag-aaral ng medikal na pag-aaral. Tandaan na ang mga numero sa panaklong ([1], [2], atbp) ay maaaring i-click na mga link sa mga pag-aaral na ito.
Kung sa tingin mo na ang alinman sa aming nilalaman ay hindi tumpak, hindi napapanahon, o kung hindi pinag-uusapan, mangyaring piliin ito at pindutin ang Ctrl + Enter.
Ang Acquired immunodeficiency syndrome ay nakilala bilang isang partikular na sakit noong 1981 sa United States, nang ang ilang kabataan ay nagkaroon ng malubhang sakit na dulot ng mga microorganism na hindi pathogen o mahinang pathogenic para sa mga malulusog na tao. Ang isang pag-aaral ng immune status ng mga pasyente ay nagpakita ng isang matalim na pagbaba sa bilang ng mga lymphocytes sa pangkalahatan at T-helpers sa partikular. Ang kundisyong ito ay tinatawag na AIDS (Acquired Immune Deficiency Syndrome). Ang paraan ng impeksiyon (sekswal na pakikipag-ugnayan, sa pamamagitan ng dugo at mga paghahanda nito) ay nagpahiwatig ng nakakahawang katangian ng sakit.
Ang causative agent ng AIDS ay natuklasan noong 1983 nang nakapag-iisa ng Frenchman na si L. Montagnier, na tinawag itong LAV Lymphoadenopathy Associated Virus, dahil natagpuan niya ito sa isang pasyente na may lymphadenopathy; at ang American R. Gallo, na tinawag ang virus na HTLV-III (Human T-lymphotropic Virus III): dati niyang natuklasan ang mga lymphotropic virus na I at II.
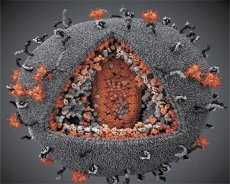
Ang paghahambing ng mga katangian ng LAV at HTLV-III na mga virus ay nagpakita ng kanilang pagkakakilanlan, kaya upang maiwasan ang pagkalito, ang virus ay pinangalanang HIV (Human Immunodeficiency Virus, o HIV) noong 1986. Ang HIV ay spherical na hugis, na may diameter na 110 nm. Ang sobre ng virus ay may hugis ng polyhedron, na binubuo ng 12 pentagons at 20 hexagons. Sa gitna at mga sulok ng bawat hexagon ay isang molekula ng glycosylated protein gpl20 (ang bilang na 120 ay nagpapahiwatig ng molekular na timbang ng protina sa kilodaltons). Isang kabuuan ng 72 gpl20 molecules ay matatagpuan sa ibabaw ng virion sa anyo ng mga kakaibang spike, na ang bawat isa ay nauugnay sa intramembrane protein gp41. Ang mga protina na ito, kasama ang double lipid layer, ay bumubuo ng supercapsid (membrane) ng virion.
Ang mga protina ng gpl20 at gp41 ay nabuo sa pamamagitan ng pagputol ng Env precursor protein ng isang cellular protease. Ang gp41 na protina ay bumubuo ng spike na "stem" sa pamamagitan ng pagbubuklod sa cytoplasmic domain nito sa matrix protein p17MA na matatagpuan mismo sa ilalim ng sobre. Ang mga molekula ng p17 ay nakikipag-ugnayan sa panahon ng pagkahinog ng virion upang bumuo ng isang icosahedron na nasa ilalim ng sobre.
Sa gitnang bahagi ng virion, ang p24 na protina ay bumubuo ng isang hugis-kono na capsid. Ang makitid na bahagi ng capsid ay konektado sa virion membrane na may partisipasyon ng rb protein. Sa loob ng capsid, mayroong dalawang magkaparehong molekula ng viral genomic RNA. Ang mga ito ay konektado sa pamamagitan ng kanilang 5' dulo sa nucleocapsid protein p7NC. Ang protina na ito ay kawili-wili dahil mayroon itong dalawang amino acid residues (motifs) na mayaman sa cysteine at histidine at naglalaman ng isang Zn atom - sila ay tinatawag na "zinc fingers" dahil kinukuha nila ang mga molekula ng genomic RNA para isama sa bumubuo ng mga virion. Ang capsid ay naglalaman din ng tatlong enzymes. Kasama sa Revertase (RT), o pol complex, ang reverse transcriptase, RNase H at DNA-dependent DNA polymerase. Ang Revertase ay naroroon bilang isang heterodimer p66/p51. Protease (PR) - p10, nagsisimula at nagpapatupad ng proseso ng virion maturation. Integrase (IN) - tinitiyak ng p31, o endonuclease, ang pagsasama ng proviral DNA sa host cell genome. Ang capsid ay naglalaman din ng isang molekula ng panimulang RNA (tRNAl"3).
Ang RNA genome sa cell ay na-convert sa isang DNA genome (DNA provirus) sa tulong ng reverse transcriptase, na binubuo ng 9283 na mga pares ng nucleotide. Ito ay hangganan sa kaliwa at kanan ng tinatawag na mahabang terminal repeats, o LTRs: S'-LTR sa kaliwa at 3'-LTR sa kanan. Ang mga LTR ay naglalaman ng 638 mga pares ng nucleotide bawat isa.
Ang HIV genome ay binubuo ng 9 na genes, ang ilan ay nagsasapawan sa mga dulo (may ilang reading frames) at may exonintron structure. Kinokontrol nila ang synthesis ng 9 na istruktura at 6 na regulatory protein.
Ang kahalagahan ng mga LTR para sa viral genome ay naglalaman ang mga ito ng mga sumusunod na elemento ng regulasyon na kumokontrol sa paggana nito:
- signal ng transkripsyon (rehiyon ng tagapagtaguyod);
- poly-A karagdagan signal;
- signal ng capping;
- signal ng pagsasama;
- positibong signal ng regulasyon (TAR para sa protina ng TAT);
- negatibong elemento ng regulasyon (NRE para sa NEF na protina);
- isang site para sa attachment ng primer RNA (tRNA™3) para sa minus-strand DNA synthesis sa 3' dulo; isang signal sa 5' dulo ng LTR na nagsisilbing panimulang aklat para sa plus-strand DNA synthesis.
Sa karagdagan, ang LTR ay naglalaman ng mga elementong kasangkot sa regulasyon ng mRNA splicing, packaging ng vRNA molecules sa capsid (Psi element). Sa wakas, sa panahon ng genome transcription, dalawang signal ang nabuo sa mahabang mRNA para sa REV protein, na nagpapalit ng synthesis ng protina: CAR - para sa mga regulatory protein at CRS - para sa mga istrukturang protina. Kung ang REV protein ay nagbubuklod sa CAR, ang mga istrukturang protina ay synthesize; kung wala ito, ang mga regulatory protein lamang ang na-synthesize.
Ang mga sumusunod na regulatory gene at ang kanilang mga protina ay gumaganap ng isang partikular na mahalagang papel sa pag-regulate ng paggana ng genome ng virus:
- TAT protein, na nagsasagawa ng positibong kontrol sa viral replication at kumikilos sa pamamagitan ng TAR regulatory region;
- Mga protina ng NEV at VPU, na nagsasagawa ng negatibong kontrol sa pagtitiklop sa pamamagitan ng rehiyon ng NRE;
- REV protein, na nagsasagawa ng positibo-negatibong kontrol. Kinokontrol ng REV protein ang gawain ng gag, pol, env genes at nagsasagawa ng negatibong regulasyon ng splicing.
Kaya, ang pagtitiklop ng HIV ay nasa ilalim ng triple control - positibo, negatibo at positibo-negatibo.
Tinutukoy ng VIF protein ang infectivity ng bagong synthesize na virus. Ito ay nauugnay sa p24 capsid protein at naroroon sa virion sa dami ng 60 molecule. Ang NEF na protina ay kinakatawan sa virion ng isang maliit na bilang ng mga molekula (5-10), posibleng nauugnay sa sobre.
Pinipigilan ng protina ng VPR ang cell cycle sa yugto ng G2, nakikilahok sa transportasyon ng mga preintegration complex sa cell nucleus, pinapagana ang ilang mga viral at cellular genes, at pinatataas ang kahusayan ng pagtitiklop ng virus sa mga monocytes at macrophage. Ang lokasyon ng mga protina ng VPR, TAT, REV, at VPU sa virion ay hindi pa naitatag.
Bilang karagdagan sa sarili nitong mga protina, ang virion membrane ay maaaring maglaman ng ilang mga protina ng host cell. Ang mga protina ng VPU at VPR ay lumahok sa regulasyon ng pagpaparami ng viral.
Antigenic na variant ng human immunodeficiency virus (HIV)
Ang human immunodeficiency virus (HIV) ay napaka-variable. Kahit na mula sa katawan ng isang pasyente, ang mga strain ng virus ay maaaring ihiwalay na malaki ang pagkakaiba sa mga katangian ng antigenic. Ang ganitong pagkakaiba-iba ay pinadali ng masinsinang pagkasira ng mga selulang CD4+ at isang malakas na tugon ng antibody sa impeksyon sa HIV. Ang isang bagong anyo ng HIV, HIV-2, biologically malapit sa HIV-1 ngunit immunologically naiiba mula dito, ay ihiwalay mula sa mga pasyente mula sa West Africa. Ang homology ng pangunahing istraktura ng mga genome ng mga virus na ito ay 42%. Ang DNA provirus HIV-2 ay naglalaman ng 9671 bp, at ang LTR nito - 854 bp. Ang HIV-2 ay kasunod na ibinukod sa ibang mga rehiyon ng mundo. Walang cross-immunity sa pagitan ng HIV-1 at HIV-2. Dalawang malalaking anyo ng HIV-1 ang kilala: O (Outlier) at M (Major), ang huli ay nahahati sa 10 subtypes (AJ). Walong subtypes (AH) ang umiikot sa Russia.
 [ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
[ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
Ang mekanismo ng pakikipag-ugnayan ng HIV sa cell
Ang pagkakaroon ng pagtagos sa katawan, ang virus ay unang umaatake sa mga cell na naglalaman ng CD4 receptor na tiyak dito. Ang receptor na ito ay naroroon sa maraming dami sa T-helpers, sa mas maliit na dami sa macrophage at monocytes, at ang T-helpers ay partikular na sensitibo sa virus.
Kinikilala ng human immunodeficiency virus (HIV) ang mga CD4 receptors gamit ang gpl20 protein nito. Ang proseso ng pakikipag-ugnayan ng HIV sa cell ay nangyayari ayon sa sumusunod na pamamaraan: receptor-mediated adsorption -> coated pit -> coated vesicle -> lysosome. Sa loob nito, ang virion membrane ay sumasama sa lysosome membrane, at ang nucleocapsid, na napalaya mula sa supercapsid, ay pumapasok sa cytoplasm; sa daan patungo sa nucleus, ito ay nawasak, at ang genomic RNA at mga nauugnay na pangunahing bahagi ay inilabas. Pagkatapos, i-synthesize ng reverse transcriptase ang minus strand ng DNA sa virion RNA, pagkatapos ay sinisira ng RNase H ang virion RNA, at ang viral DNA polymerase ay synthesize ang plus strand ng DNA. Ang 5'-LTR at 3'-LTR ay nabuo sa mga dulo ng DNA provirus. Ang DNA provirus ay maaaring manatili sa nucleus sa loob ng ilang oras sa isang hindi aktibong anyo, ngunit sa lalong madaling panahon ito ay isinama sa chromosome ng target na cell sa tulong ng integrase nito. Sa loob nito, ang provirus ay nananatiling hindi aktibo hanggang ang ibinigay na T-lymphocyte ay naisaaktibo ng microbial antigens o iba pang mga immunocompetent na mga cell. Ang pag-activate ng cellular DNA transcription ay kinokontrol ng isang espesyal na nuclear factor (NF-kB). Ito ay isang DNA-binding protein at ginawa sa maraming dami sa panahon ng pag-activate at paglaganap ng T-lymphocytes at monocytes. Ang protina na ito ay nagbubuklod sa ilang mga sequence ng cellular DNA at mga katulad na LTR na sequence ng DNA provirus at nag-uudyok ng transkripsyon ng parehong cellular DNA at DNA provirus. Sa pamamagitan ng pag-uudyok sa transkripsyon ng DNA provirus, isinasagawa nito ang paglipat ng virus mula sa isang hindi aktibong estado patungo sa isang aktibo at, nang naaayon, mula sa isang patuloy na impeksyon sa isang produktibo. Ang provirus ay maaaring manatili sa isang hindi aktibong estado sa loob ng napakahabang panahon. Ang pag-activate ng virus ay isang kritikal na sandali sa pakikipag-ugnayan nito sa cell.
Mula sa sandaling ang virus ay tumagos sa cell, ang panahon ng impeksyon sa HIV ay nagsisimula - ang estado ng carrier ng virus, na maaaring tumagal ng 10 taon o higit pa; at mula sa sandaling ang virus ay aktibo, ang sakit ay nagsisimula - AIDS. Sa tulong ng mga regulatory genes nito at ng kanilang mga produkto, ang virus ay nagsisimulang aktibong magparami. Maaaring pataasin ng protina ng TAT ang rate ng pagpaparami ng virus ng 1000 beses. Ang transkripsyon ng viral ay kumplikado. Kabilang dito ang pagbuo ng parehong full-length at subgenomic mRNA, mRNA splicing, at pagkatapos ay nangyayari ang synthesis ng structural at regulatory proteins.
Ang synthesis ng mga istrukturang protina ay nangyayari tulad ng sumusunod. Una, ang Pr55Gag precursor polyprotein (isang protina na may molekular na timbang na 55 kDa) ay na-synthesize. Naglalaman ito ng 4 na pangunahing domain: matrix (MA), capsid (CA), nucleocapsid (NC), at ang rb domain, kung saan, bilang isang resulta ng pagputol ng Pr55Gag ng viral protease (ito ay self-cut mula sa isa pang precursor protein, Gag-Pol), ang mga istrukturang protina na p17, p24, p7, at rb ay nabuo, ayon sa pagkakabanggit. Ang pagbuo ng Pr55Gag polyprotein ay ang pangunahing kondisyon para sa pagbuo ng mga viral particle. Ito ang protina na tumutukoy sa virion morphogenesis program. Ito ay sunud-sunod na kinabibilangan ng mga yugto ng transportasyon ng Gag polyprotein sa lamad ng plasma, pakikipag-ugnayan dito, at mga pakikipag-ugnayan ng protina-protina sa panahon ng pagbuo ng viral particle at ang pag-usbong nito. Ang Pr55Gag ay na-synthesize sa mga libreng polyribosomes; Ang mga molekula ng protina ay dinadala sa lamad, kung saan sila ay naka-angkla ng kanilang mga hydrophobic na rehiyon. Ang CA domain ay gumaganap ng pangunahing papel sa paglikha ng katutubong conformation ng Gag protein. Tinitiyak ng domain ng NC ang pagsasama (sa tulong ng "zinc fingers") ng 2 molekula ng genomic RNA sa komposisyon ng bumubuo ng viral particle. Ang molekula ng polyprotein sa una ay dimerize dahil sa pakikipag-ugnayan ng mga domain ng matrix. Pagkatapos ang mga dimer ay pinagsama sa hexameric (ng 6 na yunit) na mga complex bilang resulta ng pakikipag-ugnayan ng mga domain ng CA at NC. Sa wakas, ang mga hexamer, na sumasali sa kanilang mga lateral surface, ay bumubuo ng mga immature spherical virions, sa loob kung saan nakapaloob ang genomic viral RNA, na nakuha ng domain ng NC.
Ang isa pang precursor protein, ang Prl60Gag-Pol (isang protina na may molecular weight na 160 kDa), ay na-synthesize bilang resulta ng isang frameshift ng ribosome sa panahon ng pagsasalin ng 3'-end ng gag gene sa rehiyon na matatagpuan kaagad sa upstream ng rehiyon na naka-encode ng rb protein. Ang Gag-Pol polyprotein na ito ay naglalaman ng hindi kumpletong Gag protein sequence (1-423 amino acids) at Pol sequence na kinabibilangan ng PR, RT, at IN na mga domain. Ang mga molekulang polyprotein ng Gag-Pol ay na-synthesize din sa mga libreng polyribosomes at dinadala sa lamad ng plasma. Ang Prl60Gagpol polyprotein ay naglalaman ng lahat ng intermolecular interaction site at membrane binding site na likas sa Gag polyprotein. Samakatuwid, ang mga molekula ng polyprotein ng Gag-Pol ay nagsasama sa lamad at, kasama ang mga molekula ng Gag, ay kasama sa bumubuo ng mga virion, na nagreresulta sa paglitaw ng aktibong protease at ang simula ng proseso ng pagkahinog ng virion. Ang HIV-1 protease ay lubos na aktibo lamang sa anyo ng isang dimer, samakatuwid, para sa self-excision nito mula sa Prl60Gag-Pol, kinakailangan ang dimerization ng mga molekulang ito. Ang pagkahinog ng Virion ay binubuo ng katotohanan na ang inilabas na aktibong protease ay pumutol sa prl60Gag-Pol at Gag55 sa mga site na kinikilala nito; protina p17, p24, p7, p6, revertase, integrase ay nabuo at ang kanilang kaugnayan sa viral istraktura ay nangyayari.
Ang Env protein ay na-synthesize sa mga ribosome na nauugnay sa mga lamad ng endoplasmic reticulum, pagkatapos ito ay glycosylated, pinutol ng isang cellular protease sa gp120 at gp41, at dinadala sa ibabaw ng cell. Sa kasong ito, ang gp41 ay tumagos sa lamad at nagbubuklod sa mga domain ng matrix ng molekula ng protina ng Gag na nauugnay sa panloob na ibabaw ng lamad. Ang koneksyon na ito ay napanatili sa mature na virion.
Kaya, ang pagpupulong ng mga partikulo ng viral ay binubuo ng pagsasama-sama ng mga precursor protein at nauugnay na mga molekula ng RNA sa plasma membrane ng host cell, ang pagbuo ng mga immature virions at ang kanilang paglabas sa pamamagitan ng budding mula sa ibabaw ng cell. Sa panahon ng budding, napapalibutan ng virion ang sarili nito ng isang cell membrane kung saan naka-embed ang mga molekula ng gp41 at gp120. Sa panahon ng namumuko o, marahil, pagkatapos ng pagpapakawala ng mga virion, nangyayari ang kanilang pagkahinog, na isinasagawa sa tulong ng isang viral protease at binubuo ng proteolytic cutting ng mga precursor protein na Pr55Gag at Prl60Gag-Pol sa mga protina ng mature na virus at ang kanilang pagkakaugnay sa ilang mga structural complex. Ang nangungunang papel sa mga proseso ng viral morphogenesis ay nilalaro ng precursor polyprotein Pr55Gag, na nag-aayos at nagtitipon ng wala pa sa gulang na virion; ang proseso ng pagkahinog nito ay nakumpleto ng isang tiyak na viral protease.
Mga sanhi ng immunodeficiency
Ang isa sa mga pangunahing sanhi ng immunodeficiency sa impeksyon sa HIV ay ang malawakang pagkamatay ng mga T-helpers. Nangyayari ito bilang resulta ng mga sumusunod na kaganapan. Una, ang mga T-helper na nahawaan ng virus ay namamatay dahil sa apoptosis. Ito ay pinaniniwalaan na sa mga pasyente ng AIDS, ang pagtitiklop ng viral, apoptosis, at pagbaba ng bilang ng mga T-helper ay magkakaugnay. Pangalawa, kinikilala at sinisira ng mga T-killer ang mga T-cell na nahawaan ng virus o nagdadala ng mga adsorbed na molekula ng gpl20, gayundin ang mga T-helper na nahawaan ng virus at hindi nahawahan ng virus, na bumubuo ng mga symplast (syncytium) na binubuo ng ilang dosenang mga cell (ang ilan sa kanila ay namamatay bilang resulta ng pagpaparami ng mga virus sa kanila). Bilang resulta ng pagkasira ng isang malaking bilang ng mga T-helpers, mayroong pagbaba sa pagpapahayag ng mga receptor ng lamad sa B-lymphocytes sa interleukin-2, ang synthesis ng iba't ibang interleukins (mga kadahilanan ng paglaki at pagkita ng kaibhan ng B-lymphocytes - IL-4, IL-5, IL-6, atbp.) ay nakakagambala sa paggana ng T-sistema, na nagreresulta sa pagkagambala sa T-system. Ang aktibidad ng mga sistema ng pandagdag at macrophage ay pinigilan. Ang mga macrophage at monocytes na nahawaan ng virus ay hindi namamatay nang mahabang panahon, ngunit hindi nila maalis ang virus mula sa katawan. Sa wakas, dahil sa pagkakatulad ng istruktura at antigenic ng gpl20 sa mga receptor ng ilang epithelial cells ng katawan (kabilang ang mga trophoblast receptor na namamagitan sa transmisyon ng HIV), ang mga antireceptor antibodies na may malawak na spectrum ng pagkilos ay na-synthesize. Ang ganitong mga antibodies ay maaaring harangan ang iba't ibang mga cellular receptor at gawing kumplikado ang kurso ng sakit na may mga autoimmune disorder. Ang kinahinatnan ng impeksyon sa HIV ay ang pagkatalo ng lahat ng pangunahing link ng immune system. Ang mga naturang pasyente ay nagiging walang pagtatanggol laban sa iba't ibang uri ng mga mikroorganismo. Ito ay humahantong sa pag-unlad ng mga oportunistikong impeksyon at mga tumor. Para sa mga pasyenteng may impeksyon sa HIV, ang panganib na magkaroon ng hindi bababa sa tatlong uri ng kanser ay tumaas: Kaposi's sarcoma; carcinoma (kabilang ang kanser sa balat); B-cell lymphoma, na nangyayari dahil sa malignant na pagbabago ng B-lymphocytes. Gayunpaman, ang HIV ay hindi lamang lymphocytotropic, kundi pati na rin neurotropic. Ito ay tumagos sa mga selula ng central nervous system (astrocytes) kapwa sa pamamagitan ng receptor-mediated endocytosis at sa pamamagitan ng phagocytosis ng mga lymphoblast na nahawaan ng virus ng mga astrocytes. Kapag ang virus ay nakikipag-ugnayan sa mga astrocytes, ang mga symplast ay nabuo din, na nagpapadali sa pagkalat ng pathogen sa pamamagitan ng mga intercellular channel. Ang virus ay maaaring magpatuloy sa macrophage at monocytes sa loob ng mahabang panahon, kaya nagsisilbi sila bilang isang reservoir at namamahagi nito sa katawan, na maaaring tumagos sa lahat ng mga tisyu. Ang mga nahawaang macrophage ay may malaking papel sa pagpapapasok ng HIV sa central nervous system at sa pinsala nito. Sa 10% ng mga pasyente, ang mga pangunahing klinikal na sindrom ay nauugnay sa pinsala sa gitnang sistema ng nerbiyos at nagpapakita bilang demensya. Kaya, ang mga taong nahawaan ng HIV ay nailalarawan sa pamamagitan ng 3 grupo ng mga sakit - mga oportunistikong impeksyon,mga sakit sa tumor at pinsala sa central nervous system.
Epidemiology ng impeksyon sa HIV
Ang pinagmulan ng impeksyon sa HIV ay isang tao lamang - isang taong may sakit o isang carrier ng virus. Ang human immunodeficiency virus (HIV) ay nakapaloob sa dugo, tamud, cervical fluid; sa mga ina na nagpapasuso - sa gatas ng ina. Ang impeksiyon ay nangyayari sa sekswal na paraan, sa pamamagitan ng dugo at mga paghahanda nito, gayundin mula sa ina hanggang sa anak bago, habang at pagkatapos ng panganganak. Ang mga kaso ng impeksyon sa virus sa pamamagitan ng pagkain, inumin at kagat ng insekto ay hindi alam.
Ang pagkalulong sa droga ay nakakatulong sa pagkalat ng AIDS. Ang insidente ng HIV ay lumalaki taun-taon. Ayon sa WHO, mula 1980 hanggang 2000, 58 milyong tao ang nahawaan ng HIV. Noong 2000 lamang, 5.3 milyong tao ang nahawahan sa buong mundo, at 3 milyong tao ang namatay mula sa AIDS. Noong Enero 1, 2004, 264 libong mga taong nahawaan ng HIV ang nakarehistro sa Russia. Kalahati ng mga taong nahawaan ng HIV ay namamatay sa loob ng 11-12 taon mula sa sandali ng impeksyon. Sa simula ng 2004, sa bawat 100 libong mamamayan ng Russia, humigit-kumulang 180 ang nabuhay na may diagnosis ng "HIV infection". Ito ay hinuhulaan na sa ganitong antas ng morbidity, ang kabuuang bilang ng mga taong nahawaan ng HIV sa Russia pagsapit ng 2012 ay magiging 2.5-3 milyong katao. Ang pagiging kumplikado ng paglaban sa impeksyon sa HIV ay nakasalalay sa isang bilang ng mga kadahilanan: una, walang mga epektibong paraan ng paggamot at tiyak na pag-iwas; Pangalawa, ang incubation period para sa HIV infection ay maaaring lumampas sa 10 taon. Ang tagal nito ay depende sa sandali ng pag-activate ng T-lymphocyte at ang DNA provirus na nakapaloob sa chromosome nito. Hindi pa rin malinaw kung ang lahat ng nahawaan ng virus ay napapahamak sa AIDS o kung ang pangmatagalang pagdadala ng virus na walang sakit ay posible (na tila hindi malamang). Sa wakas, mayroong ilang mga human immunodeficiency virus (HIV-1, HIV-2), ang mga pagkakaiba sa antigenic na pumipigil sa pagbuo ng cross-immunity. Ang pagtuklas ng simian immunodeficiency virus (SIV) ay nagbigay liwanag sa tanong ng pinagmulan ng HIV. Ang SIV ay katulad ng HIV sa genome organization nito, ngunit malaki ang pagkakaiba sa pagkakasunud-sunod ng nucleotide nito. Sinasakop ng HIV-2 ang isang intermediate na posisyon sa pagitan ng HIV-1 at SIV sa serological properties nito, at mas malapit sa SIV sa nucleotide sequence nito. Kaugnay nito, iminungkahi ni VM Zhdanov na ang mga virus ng HIV-1, HIV-2 at SIV ay nagmula sa isang karaniwang ninuno. Posible, ayon kay R. Gallo, na ang isa sa mga SIV ay nakapasok sa katawan ng tao, kung saan ito ay sumailalim sa isang serye ng mga mutasyon, na nagresulta sa paglitaw ng HIV-1, HIV-2 at iba pang mga anyo nito.
Sintomas ng impeksyon sa HIV
Ang human immunodeficiency virus ay may ilang mga tampok na higit na tumutukoy sa pathogenesis ng sakit. Ang virus ay may napakataas na rate ng pagpaparami, na tinutukoy ng mga elemento ng regulasyon nito (hanggang sa 5,000 virion ang na-synthesize sa loob ng 5 minuto sa aktibong yugto). Dahil sa pagkakaroon ng fusion protein (gp41), ang virus ay nag-uudyok sa pagbuo ng malawak na syncytial na istruktura dahil sa pagsasanib ng mga infected at uninfected na T-helpers, na nagreresulta sa kanilang mass death. Ang mga molekula ng protina ng gpl20 na nabuo sa malalaking dami ay malayang umiikot sa dugo at nagbubuklod sa mga receptor ng mga hindi nahawaang T-helper, bilang isang resulta kung saan sila ay kinikilala at nawasak din ng mga T-killer. Ang virus ay maaaring kumalat sa pamamagitan ng mga intercellular channel mula sa cell patungo sa cell, kung saan ito ay nagiging mahinang naa-access sa mga antibodies.
Klinikal na pamantayan para sa impeksyon sa HIV
Sa mga nasa hustong gulang, ang impeksyon sa HIV ay na-diagnose kapag mayroon silang hindi bababa sa dalawang seryosong sintomas kasabay ng hindi bababa sa isang menor de edad na sintomas at sa kawalan ng iba pang kilalang sanhi ng immunodeficiency (kanser, congenital immunodeficiency, matinding gutom, atbp.). Ang mga malubhang sintomas ay kinabibilangan ng:
- pagbaba ng timbang ng 10% o higit pa;
- isang matagal na kondisyon ng febrile, paulit-ulit o pare-pareho;
- talamak na pagtatae.
Maliit na sintomas: patuloy na ubo, pangkalahatan na dermatitis, paulit-ulit na herpes zoster, oral at pharyngeal candidiasis, talamak na herpes simplex, pangkalahatang lymphadenopathy. Ang diagnosis ng AIDS ay ginawa sa pagkakaroon lamang ng Kaposi's sarcoma, cryptococcal meningitis, pneumocystis pneumonia. Ang klinikal na larawan ng sakit ay naiimpluwensyahan ng kasamang oportunistikong impeksiyon.
Mga paraan ng pag-culture ng human immunodeficiency virus (HIV)
Ang HIV-1 at HIV-2 ay maaaring linangin sa mga cell ng isang clone lamang ng TCV4 lymphocytes - H9, na nakuha mula sa leukemic TCV4 lymphocytes. Ang mga monolayer na kultura ng mga selula ng astrocyte, kung saan ang HIV-1 ay mahusay na dumami, ay maaari ding gamitin para sa mga layuning ito. Ang mga chimpanzee ay madaling kapitan ng HIV-1 sa mga hayop.
Ang resistensya ng virus sa panlabas na kapaligiran ay mababa. Namamatay ito sa ilalim ng impluwensya ng sikat ng araw at UV radiation, nawasak sa 80 °C sa loob ng 30 minuto, kapag ginagamot ng mga karaniwang ginagamit na disinfectant - sa loob ng 20-30 minuto. Upang disimpektahin ang materyal na naglalaman ng virus, kinakailangan na gumamit ng mga mycobactericidal disinfectant, dahil epektibo ang mga ito laban sa mga microorganism na may pinakamataas na resistensya.
Mga diagnostic sa laboratoryo ng impeksyon sa HIV
Ang pangunahing paraan para sa pag-diagnose ng virus carriage at HIV infection ay ang enzyme immunoassay. Gayunpaman, dahil sa katotohanan na ang gpl20 ay may pagkakatulad sa istruktura at antigen sa mga receptor ng ilang mga cell ng tao, kabilang ang mga receptor na nagdadala ng mga immunoglobulin sa pamamagitan ng mga epithelial cell ng mucous membrane, maaaring lumitaw sa katawan ang mga antibodies na nauugnay sa mga antibodies laban sa gpl20. Sa kasong ito, maaaring may maling positibong resulta ng ELISA. Samakatuwid, ang lahat ng positibong reaksyon ng sera ng mga paksa ay sumasailalim sa karagdagang pagsusuri gamit ang paraan ng immunoblotting, o Western blotting. Ang pamamaraang ito ay batay sa pagkakakilanlan ng mga antibodies sa ilalim ng pag-aaral pagkatapos ng kanilang electrophoretic separation at kasunod na pagsubok gamit ang may label na anti-species antibodies. Ang virological method ay bihirang ginagamit dahil sa pagiging kumplikado ng pag-culture ng virus. Ang H9 lymphocyte clone ay ginagamit upang makakuha ng mga viral antigens - ang mga kinakailangang bahagi ng diagnostic test system. Ang paraan ng CPR ay nagbibigay-daan sa pag-detect ng virus sa maagang yugto ng viremia.
Paggamot ng impeksyon sa HIV
Kinakailangang maghanap o mag-synthesize ng mga gamot na epektibong pinipigilan ang aktibidad ng reverse transcriptase (revertase) o viral protease. Pipigilan nila ang pagbuo ng DNA provirus at (o) pipigilin ang intracellular reproduction ng virus. Ang modernong diskarte para sa paggamot sa mga pasyente na nahawaan ng HIV ay batay sa prinsipyo ng pinagsamang paggamit ng mga gamot na pumipigil sa viral protease (isa sa mga gamot) at reversease (2 magkaibang gamot) - pinagsamang (triple) na therapy. Sa Russia, para sa paggamot ng mga pasyente na nahawaan ng HIV, ang pinagsamang paggamit ng 2 domestic na gamot ay inirerekomenda: phosphazide at crixivan, na partikular na pinipigilan ang pagpaparami ng HIV sa maaga at huli na mga yugto ng pagpaparami, lalo na sa pinababang aktibidad ng azidothymidine.
Ang problema ng tiyak na prophylaxis ay ang pangangailangang lumikha ng isang bakuna na magtitiyak sa pagbuo ng epektibong cell-mediated immunity batay sa virus-specific cytotoxic lymphocytes nang walang anumang makabuluhang produksyon ng mga antibodies. Ang ganitong immunity ay ibinibigay ng mga katulong ng Thl. Posible na ang mga antibodies, kabilang ang mga virus-neutralizing, ay hindi lamang hindi epektibo sa pagsugpo sa impeksyon sa HIV, ngunit sa isang mataas na antas ay pinipigilan nila ang cell-mediated immunity. Samakatuwid, ang isang bakuna laban sa HIV ay dapat matugunan, una sa lahat, ang dalawang pangunahing kinakailangan: a) maging ganap na ligtas at b) pasiglahin ang aktibidad ng T-cytotoxic lymphocytes. Pinag-aaralan ang bisa ng iba't ibang variant ng bakuna na nakuha mula sa mga napatay (na-inactivate) na virus at mula sa mga indibidwal na antigen na may mataas na proteksiyon. Ang mga naturang antigen ay maaaring ihiwalay sa mga virion mismo o i-synthesize sa kemikal. Ang isang bakuna na nilikha batay sa mga pamamaraan ng genetic engineering ay iminungkahi. Ito ay isang recombinant vaccinia virus na nagdadala ng HIV genes na responsable para sa synthesis ng antigens na may malakas na immunogenic properties. Ang tanong ng pagiging epektibo ng mga bakunang ito ay nangangailangan ng malaking oras dahil sa mahabang panahon ng pagpapapisa ng itlog ng impeksyon sa HIV at ang mataas na pagkakaiba-iba ng pathogen. Ang paglikha ng isang lubos na epektibong bakuna laban sa HIV ay isang kagyat na pangunahing problema.

