Medikal na dalubhasa ng artikulo
Mga bagong publikasyon
Rabies sa mga bata
Huling nasuri: 04.07.2025

Ang lahat ng nilalaman ng iLive ay medikal na nasuri o naka-check ang katotohanan upang masiguro ang mas tumpak na katumpakan hangga't maaari.
Mayroon kaming mahigpit na mga panuntunan sa pag-uukulan at nag-uugnay lamang sa mga kagalang-galang na mga site ng media, mga institusyong pang-akademikong pananaliksik at, hangga't maaari, ang mga pag-aaral ng medikal na pag-aaral. Tandaan na ang mga numero sa panaklong ([1], [2], atbp) ay maaaring i-click na mga link sa mga pag-aaral na ito.
Kung sa tingin mo na ang alinman sa aming nilalaman ay hindi tumpak, hindi napapanahon, o kung hindi pinag-uusapan, mangyaring piliin ito at pindutin ang Ctrl + Enter.
Ang rabies, o hydrophobia, ay isang talamak na sakit na viral na nakukuha sa pamamagitan ng kagat ng isang nahawaang hayop, na may pinsala sa sistema ng nerbiyos at pag-unlad ng malubhang encephalitis na may nakamamatay na kinalabasan.
Epidemiology
Isang salot sa kalusugan ng publiko mula noong sinaunang panahon, ang virus ng rabies ay kasalukuyang nagdudulot ng humigit-kumulang 59,000 pagkamatay ng tao bawat taon, halos lahat ay nakukuha sa pamamagitan ng kagat ng aso. Ito ay may malaking epekto sa ekonomiya sa mga umuunlad na bansa, lalo na sa Africa at Asia, na maaaring magdala ng hindi bababa sa mga pagkalugi. Gayunpaman, sa kabila ng halos 100% na rate ng pagkamatay nito, ang canine rabies ay isang ganap na maiiwasang sakit, at ang mga makasaysayang halimbawa ng pagtanggal ng canine rabies sa mauunlad na mundo ay nagpapatunay dito. [ 1 ]
Mga sanhi rabies
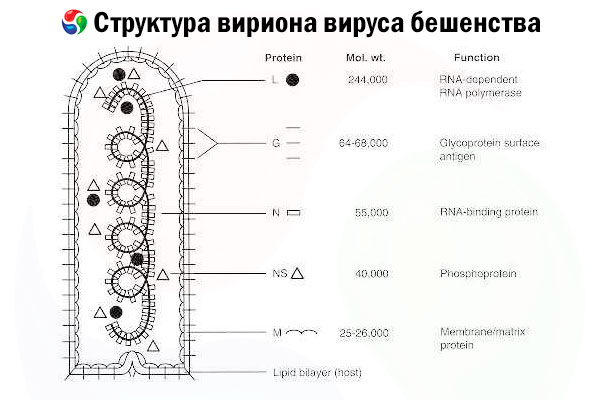
Ang causative agent ay ang rabies virus (RV), isang negatibong-strand RNA virus ng pamilya ng rhabdovirus, humigit-kumulang 60 nm × 180 nm ang laki.
Binubuo ito ng isang inner protein core, o nucleocapsid, na naglalaman ng nucleic acid, at isang panlabas na lamad, isang lipid-containing bilayer na natatakpan ng transmembrane glycoprotein spikes. Mayroon itong medyo simpleng modular genome na istraktura at nag-encode ng limang istrukturang protina:
- RNA-dependent RNA polymerase (L),
- nucleoprotein (N),
- phosphorylated protein (P),
- matrix protein (M) at
- panlabas na ibabaw glycoprotein (G).
Ang mga protina ng N, P, at L kasama ang genomic RNA ay bumubuo ng ribonucleoprotein complex. Ang G ay ang tanging RV antigen na may kakayahang mag-udyok sa paggawa ng RV neutralizing antibodies, na siyang mga pangunahing immune effector laban sa nakamamatay na impeksyon sa RV. Sa kabilang banda, ang ribonucleoprotein complex ay ipinakita na ang pangunahing RV antigen na may kakayahang mag-induce ng CD4+ T cells, na maaaring mapahusay ang produksyon ng RV neutralizing antibodies sa pamamagitan ng intrastructural antigen recognition.[ 2 ] Ang ribonucleoprotein complex ay maaaring may mahalagang papel sa pagtatatag ng immunological memory at pangmatagalang immunity.
Pag-uuri at mga uri ng antigen
Ang genus Lyssavirus ay kinabibilangan ng rabies virus at antigenically at genetically related rabies virus: Lagos, Mokola, at Duvenhage bat virus, pati na rin ang dalawang putative subtypes ng European bat lyssaviruses. Ipinapahiwatig ng mga cross-protection na pag-aaral na ang mga hayop na nabakunahan ng tradisyunal na bakuna sa rabies ay maaaring hindi ganap na maprotektahan kapag hinamon ng iba pang mga lyssavirus.
Ang mga virus ng rabies ay maaaring uriin bilang fixed (inaangkop sa pamamagitan ng pagpasa sa mga hayop o cell culture) o kalye (wild type). Ang paggamit ng mga monoclonal antibodies at genetic sequencing upang pag-iba-iba ang mga virus ng rabies sa kalye ay nakatulong sa pagtukoy ng mga variant ng viral na nagmumula sa mga pangunahing reservoir ng host sa buong mundo at sa pagmumungkahi ng mga malamang na pinagmumulan ng pagkakalantad sa tao kapag ang isang kasaysayan ng isang tiyak na kagat ng hayop ay wala sa kaso ng isang pasyente.[ 8 ]
Pathogenesis
Ang pangunahing reservoir at pinagmumulan ng impeksiyon sa mga ligaw na hayop ay mga lobo, fox, jackal, paniki, at sa mga alagang hayop - aso at pusa, bihira - kabayo, baka, baboy, daga, atbp. Ang paghahatid ng impeksyon mula sa tao patungo sa tao, bagaman posible, ay napakabihirang. Ito ay isang tipikal na zoonotic infection. Ang mga tao ay nahawaan ng rabies pangunahin mula sa mga aso.
Matapos ang isang tao ay makagat ng isang may sakit na hayop, ang virus ay dumami sa tissue ng kalamnan sa lugar ng kagat, at pagkatapos, na maabot ang mga dulo ng sensory peripheral nerves, ay kumakalat nang centripetally, na umaabot sa mga motor neuron. Ang oras na kinakailangan para sa virus ay lumipat at ang utak upang maapektuhan ay depende sa lugar ng kagat. Sa kaso ng malubhang kagat ng ulo at mukha, ang virus ay maaaring maabot ang gitnang sistema ng nerbiyos sa loob ng 15-20 araw, at sa kaso ng menor de edad na pinsala sa balat ng puno ng kahoy at mga paa at, dahil dito, ang isang maliit na dosis ng pathogen, ang proseso ng paglipat ng virus sa central nervous system ay maaaring maantala ng ilang buwan o kahit hanggang 1-1.5 taon. Nang maabot ang gitnang sistema ng nerbiyos, ang virus ay naayos sa mga tisyu ng utak at spinal cord, pangunahin sa mga neuron ng medulla oblongata, ang sungay ng Ammon, at ang base ng utak. Sa spinal cord, ang posterior horns ay pinaka-apektado. Mula sa gitnang sistema ng nerbiyos, ang virus na sentripugal kasama ang mga ugat ng nerbiyos ay umaabot sa mga glandula ng salivary, kung saan ito ay dumarami at pinalabas ng laway.
Mga konsepto sa pathogenesis ng rabies
Ang RV ay may malawak na hanay ng host at maaaring makahawa sa halos lahat ng mammal. Bagama't maraming ruta ng paghahatid ng RV ang naiulat, ang natural na impeksiyon ay kadalasang nangyayari sa pamamagitan ng isang kagat. Bilang karagdagan sa mga kagat, ang pagkonsumo ng mga bangkay na nahawaan ng RV ay maaaring magsulong ng impeksyon ng rabies virus sa mga Arctic fox, at ang pakikipag-ugnay sa RV na may mga mucous membrane ay napag-alamang isa pang posibleng ruta ng paghahatid.[ 9 ] Sa ilang mga hindi pangkaraniwang pangyayari, tulad ng hindi sinasadyang paglabas ng RV bilang aerosol sa isang laboratoryo o RV bilang isang aerosol sa mga kweba sa mga kweba . maaaring mangyari.
Hindi pa malinaw kung ang street RV at mouse-adapted o tissue culture-adapted na RV strains ay nagrereplika sa lugar ng inoculation bago sila pumasok sa CNS. Habang ang pang-eksperimentong intramuscular infection ng juvenile hamsters o raccoon na may street RV ay nagpakita ng RV replication sa striated muscle cells bago sumalakay ang virus sa motor neuron axons sa mga neuromuscular junctions, [ 11 ],[ 12 ] intramuscular infection ng mga daga na may mouse-adapted na CVS-24 RV ay nagpakita na ang RV ay lumilipat nang walang direktang replication sa C. sa mga terminal ng unmyelinated axons, ang RV ay retrogradely na dinadala sa cell body.
Iminumungkahi ng mga kamakailang natuklasan na ang transportasyon ng axonal vesicle ay maaaring kumakatawan sa isang pangunahing diskarte para sa malayuang paggalaw ng virion sa mga axon.[ 14 ] Tinatantiya na ang RV ay lumilipat sa loob ng mga axon sa bilis na 3 mm/h.[ 15 ] Ang impeksiyon ay pagkatapos ay kumakalat sa pamamagitan ng isang kadena ng mga neuron na konektado ng mga synaptic junction. Gayunpaman, ang eksaktong mekanismo na nagtataguyod ng transsynaptic na pagkalat ay hindi pa rin alam. Pagkatapos makahawa sa utak, ang virus ay kumakalat nang sentripugal sa peripheral at autonomic nervous system sa maraming peripheral na organo.[ 16 ] Sa huling yugto ng siklo ng impeksiyon, ang RV ay lumilipat sa mga glandula ng laway; pagkatapos ng replikasyon sa mucogenic acinar cells, ito ay inilalabas sa laway at handa na para sa paghahatid sa susunod na host.[ 17 ]
Sa pagsasaalang-alang sa rabies virus-induced pathology, ang apoptotic cell death ay iminungkahi bilang isang potensyal na pathogenic na mekanismo sa mga eksperimental na modelo ng rabies ng mga daga na nahawaan ng isang nakapirming strain ng RV. [ 18 ] Ang isang pathogenic na mekanismo na maaaring mag-ambag sa malalim na CNS dysfunction na katangian ng rabies ay maaaring may kapansanan sa neuronal function. Ang expression ng gene ay ipinakita na kapansin-pansing nabawasan sa mga neuron na nahawaan ng RV, na nagreresulta sa isang pangkalahatang pagsugpo sa synthesis ng protina, [ 19 ] at ilang mga pag-aaral ang nagpakita ng kapansanan sa neurotransmission kasunod ng impeksyon sa RV. Ipinakita ni Jiang na ang pagbubuklod ng isang acetylcholine receptor antagonist sa mga nahawaang homogenate ng utak ng daga ay nabawasan kumpara sa mga kontrol.[ 20 ] Ang kapansanan sa paglabas at pagbubuklod ng serotonin, isang neurotransmitter na kasangkot sa kontrol ng ikot ng pagtulog, pagdama ng sakit, at pag-uugali, ay naobserbahan din sa utak ng daga na nahawahan ng RV. [ 21 ], [ 22 ] Bilang karagdagan sa nakakaapekto sa neurotransmission, ang right ventricular infection ay maaari ring makaapekto sa mga ion channel. Ang mga nahawaang mouse neuroblastoma cells ay nagpapakita ng nabawasan na pagpapahayag ng functional na mga channel ng sodium na may boltahe, na maaaring maiwasan ang mga potensyal na pagkilos at sa huli ay humantong sa kapansanan sa paggana. [ 23 ]
Bilang karagdagan sa kawalan ng malubhang pathological lesyon sa CNS, karamihan sa mga kaso ng rabies ng tao ay hindi nakakakuha ng immune response 7 hanggang 10 araw pagkatapos ng simula ng mga klinikal na palatandaan. Ang malalalim na pagkakaibang ito sa pagitan ng pathogenesis ng rabies at ng karamihan sa iba pang viral o bacterial na impeksyon sa CNS ay higit na sinusuportahan ng katotohanan na ang immunosuppression ay alinman sa hindi epektibo o nakakapinsala sa kinalabasan ng rabies.[ 24 ] Ang mababang antas ng immune response na madalas na nakikita sa mga biktima ng rabies ay nakakapagtaka dahil hindi ito maipaliwanag ng mahinang immunogenicity ng RV antigens. Sa katunayan, ang RV G at nucleocapsid protein ay makapangyarihang B- at T-cell antigens kapag pinangangasiwaan nang parenteral. [ 25 ] Ang isang posibleng paliwanag para sa mababang antas ng immune response laban sa RV sa mga tao o hayop na may rabies ay maaaring ang RV infection ng CNS ay nagdudulot ng immunosuppression, [ 26 ] at iminungkahi na ang RV ay gumagamit ng subersibong diskarte kabilang ang pagpigil sa apoptosis at pagsira sa mga invading T cells. [ 27 ]
Ang mga attenuated na RV strain na na-adapt sa mga non-neuronal na cell ay malaki ang pagkakaiba sa mga pathogenic street RV strain sa kanilang neuroinvasiveness, na tumutukoy sa kanilang kakayahang salakayin ang CNS mula sa mga peripheral na site. Kaugnay nito, ang tissue culture-adapted RV strains ay maaaring kulang o may limitadong kakayahan lamang na salakayin ang CNS mula sa mga peripheral na site, samantalang ang mga street RV strains o mouse-adapted RV strains tulad ng CVS-24 ay lubhang invasive.[ 28 ] Ang mga pangunahing salik na kasangkot sa RV neuroinvasion ay kinabibilangan ng viral uptake, axonal transport, trans-synaptic rate, at viral replication rate.
Hanggang kamakailan lamang, ang aming kaalaman sa RV pathogenesis ay limitado at pangunahing nakabatay sa mga mapaglarawang pag-aaral ng mga street RV strains o mga eksperimentong impeksyon na may mga attenuated strain na inangkop sa laboratoryo. Ang pagdating ng reverse genetics technology ay nagbigay-daan sa amin na matukoy ang mga viral elements na tumutukoy sa pathogenic phenotype ng RV at upang mas maunawaan ang mga mekanismong kasangkot sa rabies pathogenesis.
Pagkilala sa mga elemento ng viral na kumokontrol sa pagkuha, pagpapalaganap at pagtitiklop ng rabies virus
- Mga elemento ng viral na kasangkot sa pagkuha ng virus
Ang impeksyon sa RV ay nagsisimula sa pagkakabit ng virus sa isang putative cellular receptor. Bagaman ang ilang mga molekula sa ibabaw ng lamad ay iminungkahi bilang mga RV receptor, kabilang ang nicotinic acetylcholine receptor, [ 29 ] ang neural cell adhesion molecule[ 30 ] at ang low-affinity neurotrophin receptor p75 NTR,[ 31 ] hindi pa rin malinaw kung ang mga molekula na ito ay aktwal na gumaganap ng isang papel sa siklo ng buhay ng rabies virus. Sa kontekstong ito, ipinakita kamakailan na ang pakikipag-ugnayan ng RV G–p75 NTR ay hindi kinakailangan para sa impeksyon sa RV ng mga pangunahing neuron.[ 32 ] Kasunod ng pagbibigkis ng receptor, ang RV ay isinasaloob sa pamamagitan ng adsorptive o receptor-mediated endocytosis. [ 33 ] Ang mababang pH na kapaligiran sa loob ng endosomal compartment pagkatapos ay nag-uudyok ng mga pagbabago sa conformational sa RV G na nagpapalitaw ng pagsasanib ng viral membrane sa endosomal membrane, at sa gayon ay naglalabas ng RNP sa cytoplasm. [ 34 ] Para sa mga virus, ang RV G ay gumaganap ng isang kritikal na papel sa viral uptake, malamang sa pamamagitan ng pakikipag-ugnayan sa mga putative cellular receptor na nagpapadali sa mabilis na pag-uptake. Kaugnay nito, ipinakita na ang pathogenicity ng tissue culture-adapted RV strains (eg, ERA, HEP, at CVS-11) ay nauugnay sa pagkakaroon ng isang determinant na matatagpuan sa antigenic site III ng G protein. [ 35 ] Isang Arg → Gln mutation sa posisyon 333 sa antigenic site na ito ng ERA G protein ay nagresulta sa pitong beses na pagkaantala sa internalization ng Gln333 RV variant kumpara sa wild-type na variant. Ang Asn194→Lys194 mutation sa RV G, na nagpapaliwanag sa muling paglitaw ng pathogenic phenotype, ay nauugnay sa isang makabuluhang pagbaba sa internalization time.[ 36 ] Higit pa rito, ang mga eksperimento sa chimeric RVs ay nagpakita na ang oras na kinakailangan para sa internalization ng RV virions ay makabuluhang nadagdagan at ang pathogenicity ay lubos na nabawasan ang pathogenicity ng gene ng SB na pinalitan ng RV na pinalitan ng mga pathogen. mula sa isang cDNA clone ng silver-derived bat-associated strain RV-18,[ 37 ] kasama ng highly attenuated SN strain, na nahiwalay mula sa cDNA clone ng SAD B19 RV vaccine strain.[ 38 ] Sama-sama, sinusuportahan ng mga datos na ito ang paniwala na ang RV ay isang determinasyon ng virus, na isang determinasyon ng virus ng RV. pathogenicity.
- Mga elemento ng viral na kasangkot sa pagkalat at paghahatid ng mga virus
Ang isang natatanging katangian ng rabies virus ay ang kakayahang kumalat mula sa cell patungo sa cell. Ang obserbasyon na ang variant ng Gln333 ERA ay nawawalan ng pH-dependent na cell-cell fusion activity sa vitro [ 39 ] at nagpapakita ng isang lubhang nabawasan na kakayahang kumalat mula sa cell patungo sa cell [ 40 ] ay nagmumungkahi na ang RV G ay gumaganap din ng isang mahalagang papel sa pagkalat ng cell-to-cell at samakatuwid ang paghahatid ng virus, malamang sa pamamagitan ng aktibidad na fusiogenic nito. Ang posibilidad na ito ay higit pang sinusuportahan ng paghahanap na ang rate ng pagkalat ng pathogenic RV revertant SPBNGAK ay halos dalawang beses na mas mataas kaysa sa tinukoy para sa non-pathogenic na variant ng SPBNGA. Kapansin-pansin, ang mutation ng Asn 194 → Lys 194 sa G SPBNGAK ay nagdulot ng pagbabago sa pH threshold para sa membrane fusion sa isang mas mataas na pH, na sumusuporta sa hypothesis na ang isang mas mataas na pH threshold para sa membrane fusion ay nauugnay sa pagtaas ng pagkalat ng virus. [ 41 ]
Ang mga pag-aaral ng transneuronal indicator ng impeksyon ng RV sa mga daga [ 42 ] at rhesus monkey [ 43 ] ay nagpakita na ang rabies virus ay eksklusibong lumilipat sa isang retrograde na direksyon sa mga axon. Bagama't maraming mga protina ng RV ang kasangkot sa mga mekanismo ng transportasyon ng neuronal, lumilitaw ang RV G na gumaganap ng isang nangingibabaw na papel sa transneuronal na pagkalat ng impeksyon sa RV. Halimbawa, habang ang peripheral infection na may equine infectious anemia virus (EIAV) pseudotyped na may RV G ay nagreresulta sa viral transfer sa spinal cord, ang parehong EIAV pseudotyped na may vesicular stomatitis virus G ay nabigo na makapasok sa nervous system. [ 44 ] Higit pa rito, ang pagkalat ng viral ng ERA G Arg 333 → Gln 333 mutant sa CNS ay natagpuang malakas na nabawasan kumpara sa wild-type na mutant, na nagmumungkahi pa ng isang function ng buo na RV G sa trans-synaptic spread. Gayunpaman, ang pinaka-nakakahimok na katibayan para sa isang mahalagang papel ng RV G sa trans-synaptic na transportasyon ay nagmumula sa intracranial infection ng mga daga na may recombinant G-deficient RV virus, na nagpakita na ang impeksiyon ay nanatiling limitado sa mga neuron sa lugar ng inoculation nang walang anumang ebidensya ng pagkalat sa mga pangalawang neuron.[ 45 ] Gayunpaman, malamang na bilang karagdagan sa RV virus at transsynaptic ay gumaganap din ang isang RV virus sa pagkalat ng RV, isang RV virus. transportasyon. Kaugnay nito, ipinakita na ang pagkalat ng chimeric SN-BMBG RV variant, na naglalaman ng parehong M at G mula sa highly pathogenic SB, ay makabuluhang mas mataas kaysa sa pagkalat ng chimeric SN-BG o SN-BM variant, na naglalaman ng G at M mula sa SB, ayon sa pagkakabanggit, na nagmumungkahi na ang pinakamainam na pakikipag-ugnayan ng M sa G ay maaaring may mahalagang papel sa pagkalat ng cell-to-cell virus. [ 46 ] Dahil sinusuportahan ng RV M ang pag-usbong ng virus, [ 47 ] malamang na ang mas mahusay na pagkalat ng variant ng RV SN-BMBG chimeric ay dahil sa pinakamainam na pag-usbong ng virus sa postsynaptic membrane.
Ipinakita ng mga kamakailang pag-aaral na ang pakikipag-ugnayan sa pagitan ng RV P at ng dynein light chain ay nag-uugnay sa RV RNP sa host cell transport system, at sa gayon ay pinapadali ang retrograde axonal transport ng virus.[ 48 ],[ 49 ] Gayunpaman, ang peripheral infection ng mga adult na daga ay nagpakita na ang pagtanggal ng LC8 na nagbubuklod na domain ng RV PNS ay hindi pumipigil sa pagpasok ng protina ng RV PNS na hindi direktang nagmumungkahi ng isang retrograde na protina sa CNS. pagkalat ng RV.[ 50 ]
- Mga elemento ng viral na kumokontrol sa pagtitiklop ng viral
Hindi tulad ng maraming iba pang mga virus, tulad ng influenza virus, ang RV pathogenicity ay inversely proportional sa rate ng viral RNA synthesis at produksyon ng mga nakakahawang viral particle. Ang paghahambing ng viral mRNA at genomic RNA na antas na ginawa ng iba't ibang chimeric virus ay nagmumungkahi na ang viral RNA transcription at replication ay kinokontrol ng maraming mga kadahilanan, kabilang ang RV M, na kinilala bilang isang trans-acting factor na namamagitan sa paglipat mula sa unang mataas na antas ng mRNA synthesis patungo sa genomic RNA synthesis . na nagreresulta sa pagbuo ng isang mataas na condensed backbone-like structure na hindi kayang suportahan ang RNA synthesis.
Upang matukoy ang iba pang mga elemento ng viral na kumokontrol sa pathogenicity sa pamamagitan ng pag-regulate ng viral replication, ang 5 'terminal sequence ng highly pathogenic SB strain ay pinalitan ng sunud-sunod na mga sequence mula sa highly attenuated SN vaccine strain, na nagreresulta sa mga recombinant na virus na SB2 (terminal sequence [TS] + L), SB3 (TS + L + pseudogene [4Ψ]), SB + L + pseudogene [4Ψ], SB + L + Ψ (5) (TS + L + Ψ + G + M). Ang impeksyon sa intramuscular kasama ang mga virus ng SB at SN ng magulang at ang chimeric RVs SB2, SB3, SB4, at SB5 ay nakakuha ng pinakamataas na rate ng namamatay sa mga daga na nahawaan ng SB at walang morbidity o mortalidad sa mga daga na nahawaan ng SN. Ang pagpapalit ng TS, L, at SB ng mga kaukulang elemento mula sa SN ay nagresulta sa isang katamtamang pagbawas sa morbidity at mortality, at isang karagdagang G o G plus M exchange ay lubos na nabawasan o ganap na tinanggal ang viral pathogenicity.
Ang phenotypic characterization ng mga wild-type at chimeric na RV na ito sa tissue culture ay nagsiwalat na ang pathogenicity ng isang naibigay na RV ay inversely correlated sa kakayahan nitong magtiklop sa neuronal cells. Bagama't ang SB ay nag-replicate sa mga antas na halos 1000-tiklop na mas mababa kaysa sa SN, at ang pagpapalit ng TS, L, at sa SB ng mga antas ng SN ay may maliit na epekto sa viral growth kinetics, ang karagdagang pagpapalit ng G o G plus M ng SB ng kaukulang SN genes ay nagresulta sa isang 1-log na pagtaas sa produksyon ng virus, na nagmumungkahi na ang viral RNA replication kinetics ay higit na kinokontrol ang viral RNA replication kinetics pati na rin ang viral RNA replication kinetics pati na rin ang viral RNA replication kinetics. Ang konklusyong ito ay sinusuportahan ng data na nakuha sa mga variant ng RV G na naiiba ng isang amino acid sa kanilang mga G protein. Ang variant ng pathogenic rabies virus na SPBNGAK 194 ay gumawa ng titer ng virus sa NA cells na 1 log na mas mababa kaysa sa ginawa ng nonpathogenic na variant na SPBNGAN 194, at ang real-time na pagsusuri ng PCR ay nagpakita na ang mga rate ng viral RNA transcription at replication sa SPBNGAK-infected NA mga cell ay 5- at 10-fold na mas mataas kaysa sa SPBNGAK na mga cell na nahawahan ng 5-2 na mga cell. isang kabaligtaran na ugnayan sa pagitan ng pathogenicity at ang rate ng viral RNA synthesis at viral particle production ay ibinigay ng mga daga na nahawahan ng chimeric recombinant na mga virus kung saan ang G at M na mga gene ng attenuated na SN strain ay pinalitan ng mga mataas na pathogenic SB strain. Ang mga eksperimentong ito ay nagsiwalat ng isang makabuluhang pagtaas sa pathogenicity ng parental SN strain na nagdadala ng RV G sa pathogenic SB strain. Ang pathogenicity ay higit na nadagdagan nang ang parehong G at M mula sa SB ay ipinakilala sa SN.
Ang pagpapalit ng G o M o pareho sa SN na may kaukulang mga gene mula sa SB ay nauugnay sa isang makabuluhang pagbaba sa rate ng produksyon ng particle ng viral pati na rin ang rate ng viral RNA synthesis. Ang mga datos na ito ay nagpapahiwatig na ang parehong G at M ay gumaganap ng mahahalagang tungkulin sa RV pathogenesis sa pamamagitan ng pag-regulate ng pagtitiklop ng viral. Ang paghanap na ang pagpapalit ng G o G plus M sa SN na may G o G plus M ng SB ay nagreresulta sa isang katamtaman hanggang malakas na pagbaba sa transkripsyon at pagtitiklop ng viral RNA, ayon sa pagkakabanggit, habang ang pagpapalit ng M lamang sa SN sa M ng SB ay nagreresulta sa isang malakas na pagtaas sa transkripsyon at pagtitiklop ng viral RNA, ay nagpapahiwatig na ang RV G ay mayroon ding mahalagang regulatory function sa viral RNA transcription sa pamamagitan ng pag-iisa ng RNA o interaksyon sa pamamagitan ng protina. Ang mekanismo kung saan kinokontrol ng RV G gene ang viral RNA synthesis ay hindi alam. Ang ilang mga pagkakasunud-sunod ng nucleotide sa loob ng mga gene ng RV G, tulad ng mga kasama ang mga codon para sa Arg333 at Lys 194, ay nakilala bilang mga target para sa mga cellular miRNA. Ipinakita na ang target na pagkilala ng mga cellular miRNA ay maaaring magresulta sa positibo o negatibong regulasyon ng pagtitiklop ng viral. [ 53 ] Arg 333 → Glu 333 o Lys 194 → Ser 194 na mga pagpapalit sa loob ng RV G gene sequence ay nagreresulta sa pag-aalis ng miRNA target sequence, na kung saan ay nauugnay sa isang makabuluhang pagtaas sa rate ng viral RNA synthesis [Faber M, Thomas Jefferson University, PA, USA, nagmumungkahi din ng mahalagang papel ng miRNA host regulation] Pagtitiklop ng RV, tulad ng ipinakita para sa iba pang mga virus ng RNA kabilang ang vesicular stomatitis virus at HCV. [ 54 ], [ 55 ]
Ang regulasyon ng pagtitiklop ng viral ay lilitaw na isa sa mga mahalagang mekanismo na kasangkot sa RV pathogenesis. Upang maiwasan ang immune response at mapanatili ang integridad ng neuronal network, ang mga pathogen RV strain, ngunit hindi attenuated strains, ay maaaring mag-regulate ng kanilang growth rate. Ang isang mas mababang rate ng pagtitiklop ay malamang na makikinabang sa mga pathogenic na RV strain sa pamamagitan ng pagpapanatili ng neuronal na istraktura na ginagamit ng mga virus na ito upang maabot ang CNS. Ang isa pang paliwanag para sa mas mababang rate ng pagtitiklop ng pathogenic RV ay na, upang maiwasan ang maagang pagtuklas ng host immune system, ang virus ay nagpapanatili ng kaunting antas ng pagpapahayag ng mga antigens nito.
Relasyon sa pagitan ng RV G expression, apoptosis at pathogenicity
Kilalang-kilala na ang mga strain ng virus ng rabies sa kalye na makabuluhang mas pathogenic kaysa sa mga strain na inangkop sa tissue culture ay nagpapahayag ng napakalimitadong antas ng G at hindi nag-uudyok ng apoptosis hanggang sa huli sa infectious cycle, na nagmumungkahi na ang pathogenicity ng isang partikular na strain ng virus ay inversely correlated sa RV G expression at ang kakayahang mag-udyok ng apoptosis sa pagitan ng 56 ] Direktang katibayan ng antas ng apoptosis na nakuha sa pagitan ng Gpoptosis. recombinant RV SPBNGA-GA, na nagdadala ng dalawang magkaparehong G genes at overexpressed RV G.[ 57 ] Morpolohiyang pag-aaral ng mga neuronal na kultura na nahawaan ng recombinant na RV na ito ay nagpakita na ang cell death ay makabuluhang nadagdagan kasabay ng RV G overexpression at ang apoptosis ay ang pangunahing mekanismo na kasangkot sa RV G-mediated death. Sa partikular, ang pagbaba sa F-actin staining pagkatapos ng impeksyon sa SPBNGA-GA ay naaayon sa apoptosis-induced depolymerization ng actin filament. Bukod dito, ang bilang ng mga TUNEL-positibong nuclei sa mga neuron na nahawaan ng SPBNGA-GA ay makabuluhang nadagdagan kumpara sa mga hindi nahawahan at mga neuron na nahawaan ng SPBNGA. Gayunpaman, ang mekanismo kung saan ang RV G gene ay namamagitan sa apoptotic signaling na proseso ay nananatiling hindi alam. Iminungkahi na ang RV G expression sa itaas ng isang tiyak na threshold ay malubhang nakakagambala sa cell membrane. Malamang na ang mga apoptikong selula ay hindi mabilis na na-clear sa CNS at samakatuwid ay sumasailalim sa pangalawang nekrosis. [ 58 ] Sa kabilang banda, ang impeksyon sa RV at sa partikular na sobrang pagpapahayag ng protina ng RV G ay maaaring humantong sa pyroptosis, isang cell death pathway na katulad ng apoptosis na, hindi tulad ng apoptosis, ay nagsasangkot ng pag-activate ng caspase 1 at sa gayon ay humahantong sa nekrosis. [ 59 ] Ang antas ng nekrosis o pyroptosis na dulot ng impeksyon ng RV ay malamang na gumaganap ng isang kritikal na papel sa induction ng antiviral immunity. Habang pinapanatili ng mga apoptotic cell ang kanilang integridad ng lamad at hindi pinasisigla ang likas na pagtugon sa immune, ang mga necrotic na selula ay nagiging permeabilisado at naglalabas ng mga endogenous adjuvant na maaaring mag-trigger ng isang matatag na likas na tugon ng immune. [ 60 ]
Dahil ang antas ng apoptosis/nekrosis ay nauugnay sa RV immunogenicity, iminungkahi na ang immunostimulatory effect ng apoptotic/necrotic cells ay malamang na nag-aambag sa pagbuo ng isang proteksiyon na tugon sa immune. Samakatuwid, ang regulasyon ng RV G expression ay malamang na isang mahalagang kadahilanan sa rabies pathogenesis, dahil nagbibigay ito ng paraan para sa kaligtasan at pagpapakalat ng mga pathogenic na variant ng RV sa sistema ng nerbiyos nang hindi nagdudulot ng hayagang pinsala sa neuronal at nagdudulot ng proteksiyon na tugon ng immune na maiiwasan ang impeksyon.
Maaaring i-regulate ang expression ng RV G sa antas ng RNA synthesis, sa post-translational level, o pareho. Ang mga antas ng RV G na ipinahayag ng iba't ibang mga variant ng RV chimeric ay ipinakita na makikita ng rate ng viral RNA synthesis, na nagmumungkahi na ang pagkakaiba-iba ng regulasyon ng RV G expression ng mga variant na ito ay nagreresulta mula sa mga pagkakaiba-iba sa rate ng transkripsyon ng viral mRNA. Tulad ng mga rate ng transkripsyon ng viral RNA, ang halaga ng RV G na ipinahayag ng mga variant na ito ay inversely na nauugnay sa viral pathogenicity. Sa kabilang banda, ang impeksyon ng mga pangunahing neuronal na kultura na may mas kaunting pathogenic na variant ng RV na CVS-B2c ay nagresulta sa apat na beses na mas mataas na antas ng G protein kaysa sa impeksyon na may mataas na pathogenic na variant na CVS-N2c, sa kabila ng synthesis ng maihahambing na mga antas ng G mRNA sa parehong mga impeksyon. Ang mga eksperimento sa pulse-chase ay nagpakita na ang mas mataas na antas ng protina ng G sa mga neuron na nahawaan ng CVS-B2c ay higit sa lahat ay resulta ng isang mas mababang rate ng pagkasira ng protina ng CVS-B2c G kumpara sa protina ng CVS-N2c G. Gayunpaman, ang mekanismo na humahantong sa mas mabilis na pagkasira ng proteolytic ng protina ng CVS-N2c G ay nananatiling maipaliwanag.
Mga sintomas rabies
Ang incubation period para sa rabies ay nasa average na 30-90 araw. Sa kaso ng napakalaking impeksyon sa pamamagitan ng malalaking sugat sa ulo at mukha, maaari itong paikliin sa 12 araw. Sa mga bihirang kaso, ang incubation period ay maaaring tumagal ng 1 taon o higit pa.
Mayroong mahigpit na sunud-sunod na pagbabago ng tatlong panahon ng sakit: prodromal, excitation, paralysis.
Ang prodromal period ay nagsisimula sa hitsura ng aching o paghila ng sakit sa site ng kagat, pati na rin ang sakit sa kahabaan ng nerbiyos. Sa lugar ng peklat, maaaring may nasusunog na pandamdam, pangangati, kung minsan ay pamumula at pamamaga. Ang pasyente ay nakakaranas ng pangkalahatang karamdaman, sakit ng ulo, pagduduwal. Ang pagsusuka, isang pagtaas sa temperatura ng katawan sa 37.5-38 ° C at mga sintomas ng isang progresibong sakit sa pag-iisip ay nabanggit: nadagdagan ang reflex excitability, isang hindi maipaliwanag na pakiramdam ng pagkabalisa, takot, mapanglaw. Kadalasan ang pasyente ay nalulumbay, pinipigilan, inalis, tumangging kumain, mahinang natutulog, nagrereklamo ng madilim na pag-iisip, nakakatakot na mga panaginip. Ang prodromal period ay tumatagal ng 2-3 araw, kung minsan ay umaabot sa 7 araw. Sa pagtatapos ng panahong ito, maaaring may mga pag-atake ng pagkabalisa na may panandaliang paghihirap sa paghinga, isang pakiramdam ng paninikip sa dibdib, na sinamahan ng tachycardia at pagtaas ng rate ng paghinga.
Ang panahon ng kaguluhan ay minarkahan ng hitsura ng hydrophobia: kapag sinusubukang uminom, at pagkatapos ay sa paningin ng tubig o isang paalala nito, ang pasyente ay nakakaranas ng isang convulsive spasm ng pharynx at larynx, kung saan itinapon niya ang tabo ng tubig na may hiyawan, itinapon ang nanginginig na mga kamay, ibinalik ang kanyang ulo at katawan. Ang leeg ay nakaunat, ang isang masakit na pagngiwi ay nakakasira sa mukha, na nagiging mala-bughaw dahil sa isang spasm ng mga kalamnan sa paghinga. Ang mga mata ay namumunga, nagpahayag ng takot, humingi ng tulong, ang mga mag-aaral ay lumawak, ang paglanghap ay mahirap. Sa kasagsagan ng pag-atake, posible ang cardiac at respiratory arrest. Ang pag-atake ay tumatagal ng ilang segundo, pagkatapos ay tila bumuti ang kondisyon ng pasyente. Kasunod nito, ang mga pag-atake ng mga spasms ng mga kalamnan ng larynx at pharynx ay maaaring mangyari kahit na mula sa paggalaw ng hangin (aerophobia), maliwanag na ilaw (photophobia) o isang malakas na salita (acousticophobia). Ang mga pag-atake ay sinamahan ng psychomotor agitation, kung saan ang pasyente ay kumikilos tulad ng isang "baliw". Ang kamalayan ay dumidilim sa panahon ng pag-atake, ngunit lumilinaw sa interictal na panahon. Sa panahon ng pagkabalisa, dahil sa pagtaas ng tono ng nagkakasundo na sistema ng nerbiyos, ang mga pasyente ay nakakaranas ng isang matalim na pagtaas sa paglalaway (sialorrhea) na may kawalan ng kakayahang lumunok ng laway dahil sa spasm ng mga kalamnan ng pharyngeal. Ang pasyente ay nag-spray ng laway. Ang ilang mga pasyente ay maaaring magkaroon ng mga palatandaan ng meningism at maging opisthotonus, at ang mga kombulsyon ay karaniwan. Sa kasong ito, ang cerebrospinal fluid ay maaaring hindi magbago, ngunit sa ilang mga pasyente, ang konsentrasyon ng protina ay maaaring tumaas at ang bilang ng mga selula ay maaaring tumaas dahil sa mga lymphocytes.
Kung walang sapat na paggamot, ang mga palatandaan ng pag-aalis ng tubig ay tumataas, ang mga tampok ng mukha ay nagiging matalas, at ang timbang ng katawan ay bumababa. Ang temperatura ng katawan ay tumataas sa mataas na halaga. Posible ang mga kombulsyon. Ang tagal ng yugto ng paggulo ay tungkol sa 2-3 araw, bihirang 4-5 araw. Ang isang nakamamatay na kinalabasan ay karaniwang nangyayari sa panahon ng isa sa mga pag-atake. Bihirang, ang pasyente ay nakaligtas hanggang sa ikatlong yugto ng sakit.
Sa panahon ng paralisis, ang pasyente ay huminahon. Ang mga pag-atake ng hydrophobia ay tumigil, ang pasyente ay maaaring uminom at lumunok ng pagkain, ang kamalayan ay malinaw. Gayunpaman, sa kabila ng maliwanag na kagalingan, ang pagkahilo, kawalang-interes, pagtaas ng depresyon, pagkalumpo ng mga limbs, pelvic disorder, paralisis ng cranial nerves sa lalong madaling panahon ay lilitaw. Ang temperatura ng katawan ay tumataas sa 42-43 °C, bumababa ang presyon ng arterial, at sa pagtatapos ng unang araw ay nangyayari ang kamatayan mula sa paralisis ng cardiovascular at respiratory centers.
Ang neutrophilic leukocytosis, pagtaas ng hemoglobin, erythrocytes, at hematocrit ay sinusunod sa peripheral blood.
Anong bumabagabag sa iyo?
Mga Form
Sa clinically, tipikal at hindi tipikal na mga anyo ay nakikilala. Kasama sa mga hindi tipikal na anyo ang lahat ng kaso nang walang pagpukaw at hydrophobia. Kasama sa mga hindi tipikal na anyo ang bulbar, cerebellar, meningoencephalitic, atbp.
Diagnostics rabies
Ang pagtuklas ng rabies antigen, antibodies, viral RNA, o virus isolation ay nagbibigay-daan sa pagsusuri ng rabies. Dahil ang anumang indibidwal na pagsusuri ay maaaring negatibo sa isang pasyente na may rabies, ang mga serial serum sample para sa rabies antibody detection, mga sample ng laway para sa viral culture, at biopsy ng balat para sa direktang immunofluorescence na pagsusuri para sa viral antigen ay kung minsan ay kinakailangan, lalo na kapag ang rabies ay lubos na pinaghihinalaang.
Ang isa sa pinakamabilis na paraan para sa pag-diagnose ng antemortem rabies sa mga tao ay ang pagsasagawa ng direktang immunofluorescence test sa isang skin biopsy ng nape ng leeg upang makita ang rabies antigen. Ang direktang pagsusuri sa immunofluorescence ay ang pinakasensitibo at partikular na paraan para sa pag-detect ng rabies antigen sa balat at iba pang sariwang tissue (hal., brain biopsy), kahit na ang mga resulta ay maaaring negatibo paminsan-minsan nang maaga sa sakit. Kung ang sariwang tissue ay hindi magagamit, ang enzymatic digestion ng mga nakapirming tissue ay maaaring tumaas ang reaktibiti ng immunofluorescence test; gayunpaman, ang pagiging sensitibo ay maaaring hindi katanggap-tanggap na mababa.
Ang diagnosis ay maaari ding itatag kung ang virus ay nakahiwalay sa laway pagkatapos ng inoculation ng neuroblastoma cells o laboratory rodents; ito ay kadalasang pinakamabisa sa unang 2-3 linggo ng pagkakasakit. Ang pagtuklas ng rabies virus-neutralizing antibodies, na kadalasang ginagawa ng rapid fluorescent focus inhibition test (RFFIT), sa serum ng mga hindi nabakunahang indibidwal ay diagnostic din. Ang pagkakaroon ng mga antibodies sa cerebrospinal fluid ay nagpapatunay sa diagnosis, ngunit maaaring lumitaw ang mga ito 2-3 araw mamaya kaysa sa serum antibodies at samakatuwid ay maaaring hindi gaanong kapaki-pakinabang sa mga unang yugto ng sakit. Habang ang serologic na tugon kasunod ng pagbabakuna ay karaniwang hindi nakikilala sa serologic na tugon na dulot ng sakit, ang pagbabakuna ay hindi karaniwang gumagawa ng mga antibodies sa cerebrospinal fluid.
Pitong kaso lamang ng rabies "recovery" sa nakalipas na 25 taon ang mahusay na dokumentado. Kahit na ang rabies virus ay hindi nakahiwalay sa alinman sa mga pasyente, ang mataas na titer ng rabies-neutralizing antibodies sa mga sample ng serum at ang pagkakaroon ng neutralizing antibodies sa cerebrospinal fluid ay malakas na sumusuporta sa diagnosis.
Ano ang kailangang suriin?
Anong mga pagsubok ang kailangan?
Iba't ibang diagnosis
Ang diagnosis ng rabies ng tao ay kadalasang ginagawa batay sa epidemiologic at clinical data at nakumpirma sa laboratoryo. Ang diagnosis ay diretso kung mayroong kasaysayan ng mga kagat ng hayop at ang buong spectrum ng mga sintomas at palatandaan ay naganap. Kung hindi, ang isang maingat ngunit mabilis na pagsusuri ng mga epidemiologic at klinikal na katangian ng hindi gaanong karaniwang mga kaso ay kinakailangan bago magsagawa ng mga partikular na pagsubok sa laboratoryo. Ang sinumang pasyente na may mga palatandaan o sintomas ng neurologic o hindi maipaliwanag na encephalitis ay dapat tanungin tungkol sa posibilidad ng pagkakalantad sa mga hayop sa mga lugar na endemic ng rabies sa loob o labas ng bansang tinitirhan. Ang kabiguang maghinala ng rabies sa ilang kamakailang pagkamatay ng tao sa Estados Unidos ay maaaring dahil sa kakulangan ng maingat na kasaysayan ng pagkakalantad.
Sa simula ng sakit, maaaring gayahin ng rabies ang maraming mga nakakahawang sakit at hindi nakakahawa. Maraming iba pang mga encephalitides, tulad ng mga sanhi ng herpesvirus at arbovirus, ay kahawig ng rabies. Ang iba pang mga nakakahawang sakit ay maaari ding gayahin ang rabies, tulad ng tetanus, cerebral malaria, rickettsiosis, at typhoid fever. Ang mga paralytic infectious na sakit na maaaring malito sa rabies ay kinabibilangan ng poliomyelitis, botulism, at herpes simian B encephalitis.
Ang mga hindi nakakahawang sakit na maaaring malito sa rabies ay kinabibilangan ng ilang mga neurological syndrome, lalo na ang acute inflammatory polyneuropathy (Guillain-Barré syndrome), gayundin ang allergic post-vaccination encephalomyelitis na pangalawa sa pagbabakuna ng rabies ng nervous tissue, pagkalason o pagkalasing sa droga, pag-alis ng alkohol, acute porphyria, at rabies rabies. Ang Guillain-Barré syndrome ay maaaring mapagkamalang paralytic rabies, at vice versa.
Sino ang dapat makipag-ugnay?
Paggamot rabies
Ang paggamot para sa rabies ay hindi nabuo. Ang pangangasiwa ng malalaking dosis ng tiyak na anti-rabies immunoglobulin at leukocyte interferon ay hindi epektibo. Ang symptomatic na paggamot ay ibinibigay upang maibsan ang paghihirap ng pasyente. Para sa layuning ito, ang pasyente ay inilalagay sa isang hiwalay na ward o kahon, isang proteksiyon na rehimen ang nilikha na naglilimita sa impluwensya ng panlabas na kapaligiran (nabawasan ang ingay, maliwanag na ilaw, daloy ng hangin). Upang mabawasan ang excitability ng central nervous system, ang mga sleeping pills, anticonvulsant, at painkiller ay inireseta. Ang balanse ng tubig ay na-normalize.
Sa paralitikong yugto, ang mga gamot ay inireseta na nagpapasigla sa aktibidad ng cardiovascular at respiratory system. Inirerekomenda na gumamit ng hyperbaric oxygenation, cerebral hypothermia, kinokontrol na mekanikal na paghinga na may kumpletong curarization ng pasyente. Gayunpaman, ang lahat ng mga pamamaraan ng paggamot ay halos hindi epektibo. Sa pinakamagandang kaso, posibleng pahabain ang buhay ng pasyente sa loob ng ilang buwan. Ang isang hindi kanais-nais na kinalabasan ay paunang natukoy ng kalubhaan ng pinsala sa stem ng utak na may pagkasira ng mga mahahalagang sentro.
Pag-iwas
Ang pagbuo ng unang bakuna sa rabies ni Pasteur noong 1885 ay naghatid sa isang panahon ng mas epektibong pagkontrol sa rabies. Sa ngayon, sa kabila ng halos 100% na dami ng namamatay sa mga tao mula sa rabies, ang sakit ay ganap na maiiwasan sa pamamagitan ng pre- at/o post-exposure na pagbabakuna. Habang sinimulan ni Pasteur at ng kanyang mga kasamahan ang pagbabakuna ng mga pribadong aso sa Paris, ang unang malawakang pagbabakuna ng mga aso ay isinagawa noong unang bahagi ng 1920s sa Japan, na minarkahan ang unang pangunahing pambansang programa sa pagkontrol ng rabies. Ang pagbabakuna sa bibig ng mga ligaw na hayop, na unang ginawa noong 1970s, ay paulit-ulit na ipinakitang epektibong nakontrol ang sakit sa mga pangunahing host ng terrestrial tulad ng mga fox, raccoon, at skunks.[ 68 ] Ang patuloy na pagbabakuna ng rabies ng mga populasyon ng reservoir na hayop sa 70% o mas mataas na mga rate ng saklaw ay maiiwasan ang pagkalat ng mga species ng virus ng reservoir at sa reservoir mula sa muling pagkalat ng virus ng RABV. [ 69 ]
Ipinahihiwatig ng phylogenetic data na ang mga lyssavirus ay nahawahan ng mga paniki bago pa sila mahawaan ng mga terrestrial mammal, at karamihan sa mga lyssavirus, kabilang ang RABV, ay umiikot pa rin sa iba't ibang uri ng paniki sa buong mundo.[ 70 ] Gayunpaman, ang mga epektibong paraan upang maiwasan ang paghahatid ng RABV sa mga paniki ay nananatiling mahirap makuha, na humahadlang sa posibilidad ng kumpletong pagpuksa ng rabies sa panahong ito. Gayunpaman, kahit na matapos ang pagkakalantad sa RABV sa pamamagitan ng kagat ng mammal na nahawaan ng rabies, ang ligtas at epektibong post-exposure prophylaxis (PEP, kabilang ang paglilinis ng sugat, rabies immune globulin, at pagbabakuna sa rabies) ay maaaring maprotektahan ang mga tao mula sa impeksyon sa rabies kung ang paggamot ay ibibigay kaagad at ayon sa mga rekomendasyon ng World Health Organization (WHO).
Ang dalawang paraan na ito ng pagpigil sa pagkamatay ng tao—ang isa ay batay sa pagbabakuna sa mga taong nalantad at ang isa ay batay sa pagbabakuna ng sapat na mga aso upang maputol ang cycle ng transmission sa pinagmulan—ay ang mga bloke ng pagbuo ng isang "isang kalusugan" na diskarte sa pag-iwas at pagkontrol sa canine rabies. Ang dalawang magkaibang paraan ng pagpigil sa pagkamatay ng tao ay itinuring na magkahiwalay na alternatibo: Strategy A, batay sa pagbibigay ng PEP sa mga tao, at Strategy B, batay sa pagbabakuna sa mga aso; o bilang mga bahagi ng pinagsamang Strategy A + B sa pagsusuri ng mga posibleng gastos ng mga alternatibong estratehiya.[ 71 ]
Ang mga bansang tulad ng Thailand ay nagkaroon ng napakalaking tagumpay sa pagpigil sa pagkamatay ng tao sa pamamagitan ng paggamit ng PEP, ngunit natagpuan din ang pagtaas ng demand at mga nauugnay na gastos na nauugnay sa paggamit ng PEP lamang. [ 72 ] Halimbawa, kumpara sa sitwasyon noong 1991, apat na beses na mas maraming tao (higit sa 400,000) ang nangangailangan ng PEP noong 2003. Ipinapakita ng kamakailang data na ang People's Republic of China, na nagbabakuna ng 15 milyong tao kada taon pagkatapos ng potensyal na pagkakalantad sa rabies, ay gumagastos ng humigit-kumulang US$650 milyon bawat taon sa PEP lamang. [ 73 ]
Ang isang mas napapanatiling diskarte ay upang maiwasan ang pagkalat ng impeksyon sa pinagmulan, sa populasyon ng hayop, habang pinapataas ang access sa PEP para sa mga nakalantad na pasyente ng tao kapag kinakailangan. Kung may political will at sapat na pondo para makontrol ang canine rabies, ang mga pagkamatay ay maaari at naalis na. Ang malawakang paggamit ng pagbabakuna ng aso ay humantong sa pag-aalis ng canine rabies mula sa ilang mga bansa, kabilang ang Malaysia noong 1954, [ 74 ] Japan noong 1956, Taiwan noong 1961, Singapore, at, lalo na, sa buong Kanlurang Europa (nasuri sa Rupprecht et al, King et al, at Gongal at Wright). [ 75 ]
Использованная литература


 [
[